题目内容
10.用98%的浓硫酸(ρ=1.84g/cm3)配制1mol/L稀硫酸100mL.(1)实验中应选用的仪器是CEFGH(填字母).
A.1000mL量筒 B.托盘天平
C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.50mL烧杯
G.100mL容量瓶 H.胶头滴管
(2)实验操作:
a.用100mL量筒量取98%的浓硫酸5.4mL;
b.选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的硫酸溶液沿玻璃棒转移到此容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒2〜3次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至离刻度线1〜2cm处;
f.盖上容量瓶瓶塞,摇匀;
g.用胶头滴管小心加蒸馏水至刻度线;
h.将配制好的溶液转移入含少量蒸馏水的试剂瓶中贮存备用.
(3)实验分析:
①正确的操作步骤是adbcegfh(填序号).
②此实验中玻璃棒的作用是搅拌和引流.
③实验操作中有两处错误,这两处错误是:
I.量取硫酸的量筒量程太大,会造成较大误差.
II.试剂瓶未干燥,会使所配溶液变稀.
④下列操作对所配溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
I 转移硫酸后,小烧杯未洗涤偏低.
II.量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中偏高.
III.定容时俯视容量瓶刻度线偏高.
分析 (1)根据稀释前后溶质的物质的量不变,计算出浓溶液的体积,选取合适的量筒,再根据配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容、摇匀等操作解答;
(2)稀释前后溶质的物质的量不变,进行解答;
(3)①再根据配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容、摇匀等;
②在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌,转移溶液时玻璃棒引流的作用;
③a中98%的浓H2SO4的物资的量浓度为c=$\frac{1000ρw}{98}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制1.84mol/L的稀硫酸100mL,需要浓硫酸的体积为V═$\frac{0.1×1.84}{18.4}$=0.01L=10mL,应选择10ml量筒,h中将配制好的溶液转移入含少量蒸馏水的试剂瓶中无形中对溶液进稀释;
④分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{v}$分析判断.
解答 解:(1)98%的浓H2SO4的物资的量浓度为c=$\frac{1000ρw}{98}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制1.84mol/L的稀硫酸100mL,需要浓硫酸的体积为V═$\frac{0.1×1.84}{18.4}$=0.01L=10mL,应选择10ml量筒,因配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容时用胶头滴管小心加蒸馏水至刻度线、摇匀等操作,所以应选用的仪器是玻璃棒、10mL量筒、50mL烧杯、100mL容量瓶、胶头滴管,故选CEFGH;
(2)稀释前后溶质的物质的量不变,则1mol/L×0.100L=18.4mol/L×V,解之得V=5.4mL,故答案为:5.4;
(3)①再根据配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容、摇匀等,所以正确的顺序为:adbcegfh,故答案为:adbcegfh;
②在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌,转移溶液时玻璃棒引流的作用,故答案为:搅拌和引流;
③a中98%的浓H2SO4的物资的量浓度为c=$\frac{1000ρw}{98}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制1.84mol/L的稀硫酸100mL,需要浓硫酸的体积为V═$\frac{0.1×1.84}{18.4}$=0.01L=10mL,应选择10ml量筒,h中将配制好的溶液转移入含少量蒸馏水的试剂瓶中无形中对溶液进稀释;故答案为:量取硫酸的量筒量程太大,会造成较大误差 试剂瓶未干燥,会使所配溶液变稀;
④I 转移硫酸后,小烧杯未洗涤,溶质的物质的量偏小,物质的量减少,所以浓度偏低,故答案为:偏低;
II.量筒为流量式仪器,将量筒洗涤后的洗涤液不能转移至容量瓶,否则会导致容量瓶内硫酸的物质的量增多,浓度偏高,故答案为:偏高;
III.定容时俯视读数,会导致溶液体积偏小,则浓度偏高,故答案为:偏高.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

| A. | 向溶解有Na2O2的水溶液中滴入2滴酚酞试液,溶液先变红振荡后褪色 | |
| B. | 氯气的性质活泼,它与氢气混合后立即发生爆炸 | |
| C. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到黑色Fe3O4 | |
| D. | 新制的氯水加入有色布条褪色,说明溶液中有Cl2存在 |
| A. | m-13=n | B. | n+5=m | C. | m+8=n | D. | n-11=m |
| 编号 | 实验内容 | 实验原理 | 气体发生装置 |
| ① | 制备氧气 | H2O2→O2 | Ⅲ |
| ② | 制备二氧化硫 | Na2SO3→SO2 | Ⅲ |
| ③ | 制备氯气 | HCl→Cl2 | Ⅰ或Ⅲ |
(2)根据表中所列实验原理,从如图1装置中选择合适的气体发生装置,将其编号填入上表中的空格中.

(3)某学习小组设计了如图2实验,将氯气依次通过下列装置以验证氯气的性质:
①通入氯气后,A中的现象是溶液变蓝色,整套实验装置存在的明显缺陷是无尾气吸收装置;
②C装置中发生反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-.
③该小组同学欲设计一个实验,证明洗气瓶B中的Na2SO3己被氧化.具体操作为:取一定量的B中溶液于一洁净的试管中,向其中加入硝酸酸化的硝酸钡溶液后,若产生白色沉淀则证明已经被氧化.你认为否 (填“是”或“否”)合理?
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑦ | |||
| 4 | ⑥ | ⑧ |
(1)②、③、④三种元素的最高价氧化物对应的水化物,其中碱性最强的是NaOH(填写化学式).
(2)②、③、⑥三种元素按原子半径由大到小的顺序排列为K>Na>Mg(用元素符号表示).
(3)元素①的气态氢化物的电子式是
 .写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.(4)元素⑨的原子结构示意图是
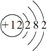 .
.元素⑤的单质的导电性介于导体和绝缘体之间,因此是一种良好的半导体材料.
(5)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(6)用离子方程式证明⑦⑧两元素非金属性的强弱Cl2+2Brˉ═Br2+2Clˉ.
| A. | 原子序数:Z>Y>X>W | |
| B. | X、Y、Z、W 形成的单质最多有 6 种 | |
| C. | X 元素最高价氧化物对应水化物的化学式为:H3XO4 | |
| D. | 四种元素的气态氢化物中,W 的气态氢化物最稳定 |

| A. | 18g 冰(图甲)中含 O-H 键数目为 4NA | |
| B. | 28g 晶体硅(图乙)中含有σ键数目为 2NA | |
| C. | 44g 干冰(图丙)中含有 NA个晶胞结构单元 | |
| D. | 石墨烯(图丁)是碳原子单层片状新材料,12g 石墨烯中含π键数目为 1.5NA |
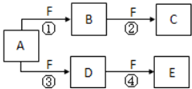 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示:
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示: .
. qZ(g)△H>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是
qZ(g)△H>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是