题目内容
5.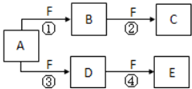 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示:
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示:回答下列问题:
(1)A的电子式为
 .
.(2)A和E反应生成G,C与G中都含有共价键(或极性共价键)(填化学键的类型).
(3)反应③中如果转移的电子为3mol,则被氧化的A为0.5mol.
(4)科学家发明了使ZX3直接用于燃料电池的方法,其装置用铂作电极,加入碱性电解质溶液,往一极通入空气,另一电极通入ZX3并使之转化为无污染的气体,试写出负极的电极反应式:2NH3-6e-+6OH-=N2+6H2O.
(5)由Z、X两元素形成的含10个电子的阳离子可和XSO4-形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-).
分析 A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,则A是NH3,氨气能连续和F单质反应,氨气能连续被氧化,则F是O2,
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍,则X是H元素、Z是N元素、Y是O元素,
D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,D为HNO2,E为HNO3,氨气被氧气氧化生成NO,则B是NO,NO被氧气氧化生成NO2,则C是NO2,再结合题目分析解答,
(1)通过以上分析知,A是氨气为共价化合物;
(2)A是氨气、E是硝酸,二者反应生成G,G为NH4NO3,C是NO2;
(3)氨气和氧气再微生物作用下生成亚硝酸,依据化学方程式电离关系计算;
(4)氨气碱性燃料电池中,负极上氨气失电子发生氧化反应生成氮气和水,正极上氧气得电子和水反应生成氢氧根离子,依据电荷守恒、原子守恒写出;
(5)Z、X两元素形成的含10个电子的阳离子是NH4+,可和HSO4-形成一种盐A,A为NH4HSO4,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,溶液中的溶质是Na2SO4、NH3.H2O、(NH4)2SO4,溶液呈中性,则c(H+)=c(OH-),依据电荷守恒和物料守恒比较判断.
解答 解:A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,则A是NH3,氨气能连续和F单质反应,氨气能连续被氧化,则F是O2,
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍,则X是H元素、Z是N元素、Y是O元素,
D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,D为HNO2,E为HNO3,氨气被氧气氧化生成NO,则B是NO,NO被氧气氧化生成NO2,则C是NO2,
(1)通过以上分析知,A是氨气,氨气中N原子和每个H原子之间都存在一个共价键,其电子式为 ,
,
故答案为: ;
;
(2)A是氨气、E是硝酸,二者反应生成G,G为NH4NO3,C是NO2,C和G都含有极性共价键,
故答案为:共价键(或极性共价键);
(3)氨气和氧气再微生物作用下生成亚硝酸,反应的化学方程式为:2NH3+3O2$\frac{\underline{\;微生物\;}}{\;}$2HNO2+2H2O,该反应中转移电子的物质的量=3mol×4=12mol,反应③中如果转移的电子为3mol,则被氧化的A的物质的量=$\frac{3mol}{12mol}$=0.5mol,
故答案为:0.5;
(4)氨气碱性燃料电池中,负极上氨气失电子发生氧化反应生成氮气和水,正极上氧气得电子和水反应生成氢氧根离子,所以负极电极反应式为2NH3-6e-+6OH-=N2+6H2O,正极电极反应式为O2+2H2O+4e-=4OH-,故答案为:2NH3-6e-+6OH-=N2+6H2O;
(5)Z、X两元素形成的含10个电子的阳离子是NH4+,可和HSO4-形成一种盐A,A为NH4HSO4,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,溶液中的溶质是Na2SO4、NH3.H2O、(NH4)2SO4,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(NH4+)=2c(SO42-),如果硫酸氢铵和NaOH以1:1反应,则溶液呈酸性,要使溶液呈中性,则氢氧化钠应该稍微过量,所以根据物料守恒得c(Na+)>c(SO42-)>c(NH4+),则溶液中所含离子浓度由大到小的顺序为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-).
点评 本题考查了无机物推断,涉及物质推断、离子浓度大小比较、原电池原理、氧化还原反应等知识点,根据物质的性质结合反应条件推断物质,再结合物质的性质、原电池原理、氧化还原反应实质等知识点来分析解答即可,难点是(5)中离子浓度大小比较,题目难度中等.


已知:Cu2O+2H+═Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)反应Ⅰ完成后,铁元素的存在形式为Fe2+(填离子符号)请写出生成该离子的离子方程式2Fe3++Cu=Cu2++2Fe2+.
(3)x、y对应的数值范围分别是3.2≤pH<4.0、5.2≤pH<5.4.
(4)电解法获取Cu时,阴极反应式为Cu2++2e-=Cu,阳极反应式为2Cl--2e-=Cl2↑.
(5)下列关于NaClO调pH的说法正确的是b.
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+═HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O═HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为5ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4HClO.
| A. | Y3X2 | B. | X2Y3 | C. | X3Y2 | D. | Y2X3 |
| A. | 由乙醇与浓H2SO4制备乙烯;则乙烯与水反应制备乙醇 | |
| B. | 由甲苯与液溴制备邻溴甲苯;由苯制备硝基苯 | |
| C. | 由乙醛与O2制备乙酸;由乙醛与H2制备乙醇 | |
| D. | 由油酸甘油酯与H2制备硬脂酸甘油酯;由硬脂酸甘油酯制备硬脂酸 |
| A. | v(NO)=0.0010mol•L-1•s-1 | B. | v(O2)=0.0010mol•L-1•s-1 | ||
| C. | v(NH3)=0.0100mol•L-1•s-1 | D. | v(H2O)=0.045mol•L-1•s-1 |
| A. | 1.8gD2O 分子中含有的质子数为 NA | |
| B. | 常温下,7.8gNa2O2中含有的阴离子个数为 0.1NA | |
| C. | 标准状况下,11.2L 18O2中所含中子数为 8NA | |
| D. | 25℃时,2.24 LCO2分子中共用电子对数目为 0.4NA |

| A. | 因水分子间存在氢键,所以水加热到很高的温度都难以分解 | |
| B. | 1mol 冰中最多含有 4×6.02×1023个氢键,水分子间的氢键可表示为 O-H…O | |
| C. | 在“H2O(s)→H2O(l)→H2+O2”的变化过程中,被破坏的主要作用依次是氢键、极性键 | |
| D. | 等质量的水和冰,因水结冰后氢键数目变少,所以冰的密度比水小 |