题目内容
20.下列操作,对实验现象的描述,或由现象作出的判断错误的是( )| A. | 向溶解有Na2O2的水溶液中滴入2滴酚酞试液,溶液先变红振荡后褪色 | |
| B. | 氯气的性质活泼,它与氢气混合后立即发生爆炸 | |
| C. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到黑色Fe3O4 | |
| D. | 新制的氯水加入有色布条褪色,说明溶液中有Cl2存在 |
分析 A.过氧化钠与水反应生成NaOH,具有碱性,且过氧化钠具有强氧化性;
B.氯气与氢气常温下不反应;
C.铁在纯氧中燃烧只生成四氧化三铁,Fe在高温下和水蒸气反应生成四氧化三铁和氢气;
D.氯水中含HClO,具有漂白性.
解答 解:A.过氧化钠与水反应生成NaOH,具有碱性,且过氧化钠具有强氧化性,则滴入2滴酚酞试液,溶液先变红振荡后褪色,故A正确;
B.氯气与氢气常温下不反应,光照、加热下反应,则常温下二者混合不发生爆炸,故B错误;
C.铁在纯氧中燃烧只生成四氧化三铁,Fe在高温下和水蒸气反应生成四氧化三铁和氢气,则均能得到黑色Fe3O4,故C正确;
D.氯水中含HClO,具有漂白性,则有色布条褪色,说明溶液中有HClO存在,不能说明溶液中有Cl2存在,故D错误;
故选BD.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及实验现象为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列各组离子能在溶液中大量共存的是( )
| A. | Fe3+、Na+、NO${\;}_{3}^{-}$、OH- | B. | NH${\;}_{4}^{+}$、Fe3+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | ||
| C. | SO${\;}_{4}^{2-}$、Cl-、Ba2+、Mg2+ | D. | H+、K+、CO${\;}_{3}^{2-}$、Cl- |
15.工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图:
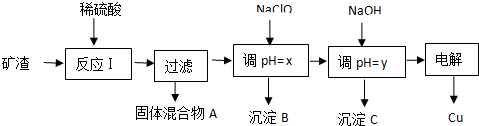
已知:Cu2O+2H+═Cu+Cu2++H2O
(1)固体混合物A中的成分是SiO2、Cu.
(2)反应Ⅰ完成后,铁元素的存在形式为Fe2+(填离子符号)请写出生成该离子的离子方程式2Fe3++Cu=Cu2++2Fe2+.
(3)x、y对应的数值范围分别是3.2≤pH<4.0、5.2≤pH<5.4.
(4)电解法获取Cu时,阴极反应式为Cu2++2e-=Cu,阳极反应式为2Cl--2e-=Cl2↑.
(5)下列关于NaClO调pH的说法正确的是b.
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+═HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O═HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为5ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4HClO.

已知:Cu2O+2H+═Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)反应Ⅰ完成后,铁元素的存在形式为Fe2+(填离子符号)请写出生成该离子的离子方程式2Fe3++Cu=Cu2++2Fe2+.
(3)x、y对应的数值范围分别是3.2≤pH<4.0、5.2≤pH<5.4.
(4)电解法获取Cu时,阴极反应式为Cu2++2e-=Cu,阳极反应式为2Cl--2e-=Cl2↑.
(5)下列关于NaClO调pH的说法正确的是b.
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+═HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O═HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为5ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4HClO.
5.“可燃冰”是天然气与水相互作用形成的晶体物质,主要存在于冻土层和海底大陆架中.据测定每0.1mL固体“可燃冰”能释放出20mL甲烷气体,则下列说法中不正确的是( )
| A. | “可燃冰”释放的甲烷属于烃 | |
| B. | “可燃冰”的分解与释放,可能会诱发海底地质灾害,加重温室效应 | |
| C. | “可燃冰”将成为人类的后续能源 | |
| D. | “可燃冰”是水变的油 |
12.下列离子方程式正确的是( )
| A. | 铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag | |
| B. | 硫酸和氢氧化铜溶液混合:H++OH-═H2O | |
| C. | 石灰石中加入稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸和氢氧化钡溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
9.下列有关化学用语或名称表达正确的是( )
| A. | 亚硫酸的电离方程式:H2SO3?2H++SO32- | |
| B. | 乙炔的分子结构模型示意图: | |
| C. | H2O2的电子式: | |
| D. |  互为同系物 互为同系物 |
 ,烷烃的通式CnH2n+2;
,烷烃的通式CnH2n+2; ,乙酸的化学性质主要由羧基决定.
,乙酸的化学性质主要由羧基决定.