题目内容
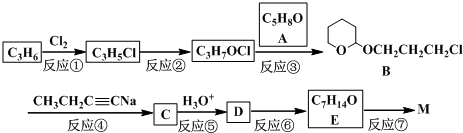
 室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线,如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线,如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )| A、a点时:c ( CH3COOH )>c ( Na+)>c ( CH3COO-)>c ( H+)>c ( OH -) |
| B、b点时:c ( Na+)=c ( CH3COO-)>c ( H+)=c ( OH-) |
| C、c点时:c ( OH-)=c ( CH3COOH )+c ( H+) |
| D、d点时:c ( Na+)>c ( CH3COO-)>c (OH-)>c ( H+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:A.a点溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性,c(H+)>c(OH-),说明醋酸的电离程度大于醋酸根离子的水解程度;
B.b点时溶液的pH=7,c(H+)=c(OH-),根据电荷守恒可知c(Na+)=c(CH3COO-);
C.c点时,恰好反应生成醋酸钠溶液,根据电荷守恒和物料守恒进行判断;
D.d点氢氧化钠过量,为NaOH和CH3COONa的混合物,溶液呈碱性.
B.b点时溶液的pH=7,c(H+)=c(OH-),根据电荷守恒可知c(Na+)=c(CH3COO-);
C.c点时,恰好反应生成醋酸钠溶液,根据电荷守恒和物料守恒进行判断;
D.d点氢氧化钠过量,为NaOH和CH3COONa的混合物,溶液呈碱性.
解答:
解:A.a点时醋酸过量,溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性,醋酸根离子的水解程度小于醋酸的电离程度,则c(CH3COO-)>c(CH3COOH),故A错误;
B.根据溶液电荷守恒可知溶液中应存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),则c(Na+)=c(CH3COO-),溶液中离子浓度关系为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故B正确;
C.c点时,氢氧化钠与醋酸恰好反应生成醋酸钠溶液,醋酸钠溶液中,根据电荷守恒可得:①c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒可得:②c(Na+)=c(CH3COO-)+c(CH3COOH),将②带人①可得:c(OH-)=c(CH3COOH)+c(H+),故C正确;
D.d点为NaOH和CH3COONa的混合物,溶质为0.002mol的醋酸钠和0.001mol的氢氧化钠,溶液呈碱性,由于CH3COO-存在微弱的水解,则有c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确.
故选A.
B.根据溶液电荷守恒可知溶液中应存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),则c(Na+)=c(CH3COO-),溶液中离子浓度关系为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故B正确;
C.c点时,氢氧化钠与醋酸恰好反应生成醋酸钠溶液,醋酸钠溶液中,根据电荷守恒可得:①c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒可得:②c(Na+)=c(CH3COO-)+c(CH3COOH),将②带人①可得:c(OH-)=c(CH3COOH)+c(H+),故C正确;
D.d点为NaOH和CH3COONa的混合物,溶质为0.002mol的醋酸钠和0.001mol的氢氧化钠,溶液呈碱性,由于CH3COO-存在微弱的水解,则有c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确.
故选A.
点评:本题考查酸碱混合的判断和离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒、盐的水解判断溶液中离子浓度大小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将质量为W1克的钠、铝共融物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为a mol/L的HCl溶液,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L.将溶液蒸干灼烧得固体W2克.n(Na)、n(Al)分别代表钠、铝的物质的量,下列关系式中不正确的是( )
| A、35.5aV2=W2-W1 |
| B、n(Al)<W1/50 |
| C、n(Na)+3n(Al)=2V1/22.4 |
| D、aV2=n(Na)+3n(Al) |
漂白粉的有效成分是( )
| A、HClO |
| B、NaClO |
| C、Ca(ClO)2 |
| D、CaCl2 |
下列有关说法正确的是( )
| A、准确称取0.4000g NaOH固体可配成100mL 0.1000mol?L-1的NaOH标准溶液 |
| B、已知Ksp[Fe(OH)3]=4.0×10-38,则Fe3++3H2O?Fe(OH)3+3H+的平衡常数K=2.5×10-5 |
| C、100mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 |
| D、对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
现有四种溶液:①pH=3的CH3COOH溶液,②pH=3的HCl溶液,③pH=11的氨水,④pH=11的NaOH溶液.相同条件下,下列有关上述溶液的叙述中,错误的是( )
| A、①、④等体积混合后,溶液显碱性 |
| B、将②、③溶液混合后,pH=7,消耗溶液的体积:②>③ |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量①最大 |
| D、向溶液中加入100 mL水后,溶液的pH:③>④>②>① |
下列表述正确的是( )
| A、原子半径:Na>Mg>O |
| B、还原性:F->Cl->S2- |
| C、酸性:H3PO4>H2SO4>HClO4 |
| D、稳定性:H2O>HF>H2S |
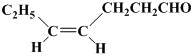 )不溶于水,是一种昂贵的食用香料,也是重要的医药中间体.M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体.
)不溶于水,是一种昂贵的食用香料,也是重要的医药中间体.M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体.