题目内容
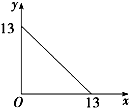 T℃下的溶液中,c(H+)=1.0×10-xmol?L-1,c(OH-)=1.0×10-ymol?L-1,x与y的关系如图所示.下列说法不正确的是( )
T℃下的溶液中,c(H+)=1.0×10-xmol?L-1,c(OH-)=1.0×10-ymol?L-1,x与y的关系如图所示.下列说法不正确的是( )| A、T℃时,水的离子积Kw为1×10-13 |
| B、T>25 |
| C、T℃时,pH=7的溶液显碱性 |
| D、T℃时,pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,溶液的pH=7 |
考点:pH的简单计算,水的电离
专题:电离平衡与溶液的pH专题
分析:A、根据KW=c(H+)×c(OH-)结合图象数据进行回答;
B、根据水的电离是吸热的,温度升高,Kw增大来判断;
C、当室温下时,pH=7的溶液是中性的;
D、pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,根据氢离子和氢氧根离子量的关系确定溶液的酸碱性.
B、根据水的电离是吸热的,温度升高,Kw增大来判断;
C、当室温下时,pH=7的溶液是中性的;
D、pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,根据氢离子和氢氧根离子量的关系确定溶液的酸碱性.
解答:
解:A、由图象可知,x=0时,y=13,y=0时,x=13,则有x+y=13,则KW=c(H+)×c(OH-)=(10-xmol?L-1)×(10-y mol?L-1)=10-13 mol2?L-2,故A正确;
B、该温度下,Kw=10-13 mol2?L-2>10-14 mol2?L-2,则温度高于常温,故B正确;
C、该温度下,Kw=10-13 mol2?L-2,T℃时,pH=6.5的溶液显中性,pH=7的溶液显碱性,故C正确;
D、该温度下,pH=12的苛性钠溶液,氢氧根浓度是0.1mol/L,pH=1的稀硫酸中氢离子浓度是0.1mol/L,等体积混合,溶液显中性,pH=6.5,故D错误.
故选D.
B、该温度下,Kw=10-13 mol2?L-2>10-14 mol2?L-2,则温度高于常温,故B正确;
C、该温度下,Kw=10-13 mol2?L-2,T℃时,pH=6.5的溶液显中性,pH=7的溶液显碱性,故C正确;
D、该温度下,pH=12的苛性钠溶液,氢氧根浓度是0.1mol/L,pH=1的稀硫酸中氢离子浓度是0.1mol/L,等体积混合,溶液显中性,pH=6.5,故D错误.
故选D.
点评:本题考查酸碱混合的定性判断,题目难度中等,注意水的离子积常数的计算,把握相关计算公式的运用.

练习册系列答案
相关题目
某反应过程能量变化如图所示,下列说法正确的是( )


| A、反应过程a有催化剂参与 |
| B、该反应为放热反应,热效应不等于△H |
| C、改变催化剂,可改变该反应的活化能 |
| D、有催化剂条件下,反应的活化能等于E1+E2 |
若某基态原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是( )
| A、该元素的基态原子中共有3个未成对电子 |
| B、该元素原子核外共有5个电子层 |
| C、该元素原子的M能层共有8个电子 |
| D、该元素属于s区 |
 O3可由臭氧发生器(原理如图)电解稀硫酸制得.下列说法不正确的是( )
O3可由臭氧发生器(原理如图)电解稀硫酸制得.下列说法不正确的是( )| A、图中阴极为B,电极反应2H++2e-=H2↑ | ||
| B、若C处通入O2,则A极的电极反应式为O2+4H++4e-=2H2O | ||
| C、若C处不通入O2,D、E分别产生的气体是氢气和氧气、臭氧的混合气体 | ||
D、若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O2所占的体积分数为
|
下列实验过程中,溶液始终无明显现象发生的是( )
| A、NO2通入FeSO4溶液中 |
| B、CO2通入CaCl2溶液中 |
| C、NH3通入AlCl3溶液中 |
| D、SO2通入酸性KMnO4溶液中 |
下列选项中所涉及的两个量一定相等的是( )
| A、11.2 L N2与14 g CO气体所含有的原子数 |
| B、电解精炼铜时阳极溶解与阴极析出的铜的质量 |
| C、6.2 g Na2O和7.8 g Na2O2中所含的离子数 |
| D、20 g重水(D2O)与17 g NH3所含有的电子数 |
有机物A是衡量一个国家石油工业是否发达的标志性物质,A在催化剂作用与水反应的产物为B,B可与食醋中的有机酸C发生反应生成D,下列说法中正确的是( )
| A、实验室制取D时,使用水浴加热 |
| B、A能与溴水和酸性KMnO4溶液发生氧化还原反应,而使它们褪色 |
| C、D的同分异构体中含有羧基的有3种 |
| D、B和C的熔点和沸点都比C2H6、C2H4的沸点和熔点高 |