题目内容
某反应过程能量变化如图所示,下列说法正确的是( )


| A、反应过程a有催化剂参与 |
| B、该反应为放热反应,热效应不等于△H |
| C、改变催化剂,可改变该反应的活化能 |
| D、有催化剂条件下,反应的活化能等于E1+E2 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、催化剂能降低反应的活化能;
B、反应物能量高于生成物;
C、不同的催化剂对反应的催化效果不同;
D、催化剂改变了反应历程,E1、E2分别代表各步反应的活化能.
B、反应物能量高于生成物;
C、不同的催化剂对反应的催化效果不同;
D、催化剂改变了反应历程,E1、E2分别代表各步反应的活化能.
解答:
解:A、b中使用了催化剂,故A错误;
B、反应物能量高于生成物,反应为放热反应,△H=生成物能量-反应物能量,故B错误;
C、不同的催化剂,反应的活化能不同,故C正确;
D、E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,故D错误.
故选C.
B、反应物能量高于生成物,反应为放热反应,△H=生成物能量-反应物能量,故B错误;
C、不同的催化剂,反应的活化能不同,故C正确;
D、E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,故D错误.
故选C.
点评:本题通过图象考查了反应的活化能,以及催化剂能够降低反应的活化能的相关知识.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于萃取操作说法正确的是( )
| A、从碘水中萃取碘,可选用酒精作为萃取剂 |
| B、萃取时所选溶剂应与原溶剂互不相溶,且与溶质不反应 |
| C、萃取后,静置分层,下层液体流出后,打开活塞,用另一只烧杯盛接剩余液体 |
| D、用四氯化碳萃取碘,静置后,上层接近无色,下层为紫红色 |
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O△H<0,在恒容的密闭容器中,下列有关说法正确的是( )
| 催化剂 |
| 180℃ |
| A、平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 |
| B、平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C、单位时间内消耗NO和N2的物质的量比为1:2时,反应没有达到平衡 |
| D、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
下列说法正确的是( )
A、已知1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化如图1,则NO2和CO反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g);△H=+234kJ/mol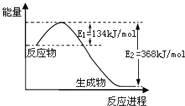 | ||||||||
B、一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| ||||||||
| C、已知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液浓度为 5.6×10-5 mol/L,则生成沉淀所需Na2CO3溶液最小浓度为 5×10-5 mol/L | ||||||||
D、在不同条件下进行的异构化反应 X?Y 的进程图解如下.图2中的“ ”是X,“ ”是X,“ ”是Y,则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小 ”是Y,则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小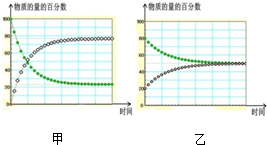 |
化学与日常生活密切相关,下列说法错误的是( )
| A、碘酒是指单质碘的乙醇溶液 |
| B、84消毒液的有效成分是NaClO |
| C、生石灰用作食品抗氧剂 |
| D、小苏打是面包发酵粉的主要成分 |
欲将蛋白质从水析出而又不改变它的性质,应加入( )
| A、酒精溶液 |
| B、Na2SO4溶液 |
| C、Pb(NO3)2溶液 |
| D、NaOH溶液 |
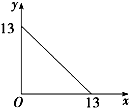 T℃下的溶液中,c(H+)=1.0×10-xmol?L-1,c(OH-)=1.0×10-ymol?L-1,x与y的关系如图所示.下列说法不正确的是( )
T℃下的溶液中,c(H+)=1.0×10-xmol?L-1,c(OH-)=1.0×10-ymol?L-1,x与y的关系如图所示.下列说法不正确的是( )| A、T℃时,水的离子积Kw为1×10-13 |
| B、T>25 |
| C、T℃时,pH=7的溶液显碱性 |
| D、T℃时,pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,溶液的pH=7 |
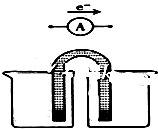 用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压数值):
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压数值):