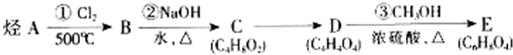题目内容
下列选项中所涉及的两个量一定相等的是( )
| A、11.2 L N2与14 g CO气体所含有的原子数 |
| B、电解精炼铜时阳极溶解与阴极析出的铜的质量 |
| C、6.2 g Na2O和7.8 g Na2O2中所含的离子数 |
| D、20 g重水(D2O)与17 g NH3所含有的电子数 |
考点:物质的量的相关计算
专题:
分析:A.11.2L CO的物质的量不一定是0.5mol;
B.粗铜作阳极,粗铜中比Cu活泼的金属也放电溶解,根据电子转移守恒,阳极溶解的Cu与阴极析出的Cu的质量不相等;
C.根据n=
计算氧化钠、过氧化钠的物质的量,二者含有阳离子与阴离子数目均为2:1;
D.根据n=
计算重水、氨气的物质的量,每个分子均含有10个电子.
B.粗铜作阳极,粗铜中比Cu活泼的金属也放电溶解,根据电子转移守恒,阳极溶解的Cu与阴极析出的Cu的质量不相等;
C.根据n=
| m |
| M |
D.根据n=
| m |
| M |
解答:
解:A.14 g CO气体的物质的量为0.5mol,而11.2L CO的物质的量不一定是0.5mol,二者含有原子数目不一定相等,故A错误;
B.粗铜作阳极,粗铜中比Cu活泼的金属也放电溶解,根据电子转移守恒,阳极溶解Cu的质量小于阴极析出的Cu的质量,故B错误;
C.1mol氧化钠含有3mol离子(2mol钠离子、1mol阳离子),1mol过氧化钠含有3mol离子(2mol钠离子、1mol过氧根离子),6.2 g Na2O的物质的量为0.1mol,7.8 g Na2O2的物质的量为0.1mol,二者物质的量相等,则含有离子数目相等,故C正确;
D.20g重水的物质的量为
=1mol,17g氨气的物质的量为
=1mol,二者物质的量相等,每个分子均含有10个电子,故含有电子数目相等,故D正确,
故选CD.
B.粗铜作阳极,粗铜中比Cu活泼的金属也放电溶解,根据电子转移守恒,阳极溶解Cu的质量小于阴极析出的Cu的质量,故B错误;
C.1mol氧化钠含有3mol离子(2mol钠离子、1mol阳离子),1mol过氧化钠含有3mol离子(2mol钠离子、1mol过氧根离子),6.2 g Na2O的物质的量为0.1mol,7.8 g Na2O2的物质的量为0.1mol,二者物质的量相等,则含有离子数目相等,故C正确;
D.20g重水的物质的量为
| 20g |
| 20g/mol |
| 17g |
| 17g/mol |
故选CD.
点评:本题考查物质的量有关计算,难度不大,B选项为易错点,学生容易忽略粗铜中比铜活泼的金属放电.

练习册系列答案
相关题目
欲将蛋白质从水析出而又不改变它的性质,应加入( )
| A、酒精溶液 |
| B、Na2SO4溶液 |
| C、Pb(NO3)2溶液 |
| D、NaOH溶液 |
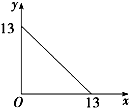 T℃下的溶液中,c(H+)=1.0×10-xmol?L-1,c(OH-)=1.0×10-ymol?L-1,x与y的关系如图所示.下列说法不正确的是( )
T℃下的溶液中,c(H+)=1.0×10-xmol?L-1,c(OH-)=1.0×10-ymol?L-1,x与y的关系如图所示.下列说法不正确的是( )| A、T℃时,水的离子积Kw为1×10-13 |
| B、T>25 |
| C、T℃时,pH=7的溶液显碱性 |
| D、T℃时,pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,溶液的pH=7 |
下列说法正确的是( )
| A、强电解质一定易溶于水 |
| B、钢铁在海水中发生电化腐蚀时,铁是阳极被氧化 |
| C、对可逆反应,升高温度一定存在v(正)>v(逆) |
| D、相同浓度时,强酸中水的电离程度比弱酸的水的电离程度小 |
在密闭容器中有可逆反应:nA(g)+mB(g)?pC(g)△H>O处于平衡状态(又知n+m>P),则下列说法正确的是:①升高温度时,
的比值减小
②降温时体系内混合气体平均相对分子质量减小
③加入B,A的转化率变大
④加入催化剂,气体的总物质的量不变
⑤充入C,
则A、B的物质的量增大( )
| c(B) |
| c(C) |
②降温时体系内混合气体平均相对分子质量减小
③加入B,A的转化率变大
④加入催化剂,气体的总物质的量不变
⑤充入C,
则A、B的物质的量增大( )
| A、③④ | B、①②⑤ |
| C、②③⑤ | D、全部 |
下列变化能够实现的是( )
①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤有单质生成的非氧化还原反应.
①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤有单质生成的非氧化还原反应.
| A、全部 | B、只有①③④ |
| C、只有②④⑤ | D、只有①②③④ |