题目内容
两个体积相同的容器,一个盛有CO,另一个盛有N2和C2H4,在同温同压下两容器内的气体一定具有相同的:①原子总数 ②质子总数 ③分子总数 ④质量( )
| A、①② | B、②③ | C、①③ | D、③④ |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:同温同压下,气体摩尔体积相等,体积相等的不同气体,其物质的量相等,CO、N2和C2H4的摩尔质量都是28g/mol,根据m=nM、N=nNA结合分子构成计算.
解答:
解:同温同压下,气体摩尔体积相等,体积相等的不同气体,其物质的量相等,CO、N2和C2H4的摩尔质量都是28g/mol,
①每个CO、氮气分子和每个乙烯分子中原子个数不等,所以其原子总数不等,故错误;
②每个CO分子和乙烯分子中质子数不等,所以其质子总数一定不相等,故错误;
③根据N=nNA知,分子数与物质的量成正比,物质的量相等,所以其分子总数一定相等,故正确;
④根据m=nM知,二者的物质的量相等、摩尔质量相等,所以其质量一定相等,故正确;
故选D.
①每个CO、氮气分子和每个乙烯分子中原子个数不等,所以其原子总数不等,故错误;
②每个CO分子和乙烯分子中质子数不等,所以其质子总数一定不相等,故错误;
③根据N=nNA知,分子数与物质的量成正比,物质的量相等,所以其分子总数一定相等,故正确;
④根据m=nM知,二者的物质的量相等、摩尔质量相等,所以其质量一定相等,故正确;
故选D.
点评:本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,熟练掌握物质的量公式,题目难度不大.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
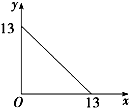 T℃下的溶液中,c(H+)=1.0×10-xmol?L-1,c(OH-)=1.0×10-ymol?L-1,x与y的关系如图所示.下列说法不正确的是( )
T℃下的溶液中,c(H+)=1.0×10-xmol?L-1,c(OH-)=1.0×10-ymol?L-1,x与y的关系如图所示.下列说法不正确的是( )| A、T℃时,水的离子积Kw为1×10-13 |
| B、T>25 |
| C、T℃时,pH=7的溶液显碱性 |
| D、T℃时,pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,溶液的pH=7 |
在密闭容器中有可逆反应:nA(g)+mB(g)?pC(g)△H>O处于平衡状态(又知n+m>P),则下列说法正确的是:①升高温度时,
的比值减小
②降温时体系内混合气体平均相对分子质量减小
③加入B,A的转化率变大
④加入催化剂,气体的总物质的量不变
⑤充入C,
则A、B的物质的量增大( )
| c(B) |
| c(C) |
②降温时体系内混合气体平均相对分子质量减小
③加入B,A的转化率变大
④加入催化剂,气体的总物质的量不变
⑤充入C,
则A、B的物质的量增大( )
| A、③④ | B、①②⑤ |
| C、②③⑤ | D、全部 |
下列变化能够实现的是( )
①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤有单质生成的非氧化还原反应.
①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤有单质生成的非氧化还原反应.
| A、全部 | B、只有①③④ |
| C、只有②④⑤ | D、只有①②③④ |
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol?L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol?L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图. NO3-+
NO3-+ ═
═ Fe2++
Fe2++ NH4++
NH4++