题目内容
5.标准状态下,在三个干燥的烧瓶中分别充入:①纯净的氨气,②纯净的NO2气体,③NO2和O2按4:1混合而成的气体.然后各做喷泉实验.实验后,三个烧瓶中溶液的物质的量浓度之比为( )| A. | 5:5:4 | B. | 2:1:2 | C. | 1:1:1 | D. | 无法确定 |
分析 气体的体积相等,相同条件下气体的物质的量相等,令气体的物质的量为1mol,则烧瓶的容积为22.4L,确定溶质的物质的量,根据物质的量浓度公式计算判断:
①纯净的氨气,完全溶于水,溶液的体积等于烧瓶容积;
②纯净的NO2气体,发生反应3NO2+H2O=2HNO3+NO,生成硝酸$\frac{2}{3}$mol,$\frac{1}{3}$molNO,所以溶液体积等于烧瓶容积的$\frac{2}{3}$;
③NO2与O2体积比4:1,NO2为$\frac{4}{5}$×1mol,发生反应4NO2+O2+2H2O=4HNO3,生成硝酸为$\frac{4}{5}$×1mol,溶液体积等于烧瓶容积.
解答 解:解:气体的体积相等,相同条件下气体的物质的量相等,令气体的物质的量为1mol,则烧瓶的容积为22.4L,
①纯净的氨气,完全溶于水,溶液的体积等于烧瓶容积,所以溶液浓度为$\frac{1mol}{22.4L}$=$\frac{1}{22.4}$mol/L;
②纯净的NO2气体,发生反应3NO2+H2O=2HNO3+NO,生成硝酸$\frac{2}{3}$mol,$\frac{1}{3}$molNO,所以溶液体积等于烧瓶容积的$\frac{2}{3}$,所以溶液的物质的量浓度为:$\frac{\frac{2}{3}mol}{\frac{2}{3}L}$=$\frac{1}{22.4}$mol/L;
③NO2为$\frac{4}{5}$×1mol,发生反应4NO2+O2+2H2O=4HNO3,生成硝酸为$\frac{4}{5}$×1mol,溶液体积等于烧瓶容积,所以溶液物质的量浓度为:$\frac{\frac{4}{5}×1mol}{22.4L}$=$\frac{1}{22.4}$×$\frac{4}{5}$mol/L;
所以实验后三个烧瓶中溶液的物质的量浓度之比为$\frac{1}{22.4}$mol/L:$\frac{1}{22.4}$mol/L:$\frac{1}{22.4}$×$\frac{4}{5}$mol/L=5:5:4,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确反应后溶质组成及溶液体积为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案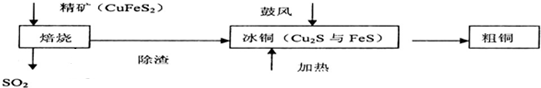
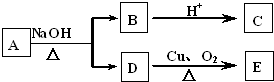
| A. | 焙烧时硫元素全部转化为二氧化硫 | B. | 在焙烧时氧化剂只有氧气 | ||
| C. | 粗铜精炼时用粗铜做阴极 | D. | Cu2S可用于火法炼制铜 |
| A. | 各元素的最高正化合价跟族的序数相等 | |
| B. | 所有元素都有正化合价和负化合价,它们的绝对值之和等于8 | |
| C. | 非金属元素的负化合价,等于原子最外层达到8个电子稳定结构所需得到的电子数 | |
| D. | 各元素原子的最外层电子数跟族序数相等 |
| A. | 熔点:MgO>CaS | B. | 熔点:Li>Na | ||
| C. | 沸点:SiCl4>CF4 | D. | 沸点:邻硝基苯酚>间硝基苯酚 |
 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )| A. | 醋酸的电离程度由大到小的顺序:b>c>a | |
| B. | 溶液的pH由大到小的顺序:a>c>b | |
| C. | 用湿润的pH试纸测量醋酸溶液的pH,测量结果均偏大 | |
| D. | 溶液中$\frac{{c(C{H_3}COOH)}}{{c(C{H_3}CO{O^-})}}$的数值不变 |