题目内容
5.下列热化学方程式中,正确的是( )| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
分析 A、燃烧热生成稳定的氧化物,水是液态;
B、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol;
C、依据热化学方程式的书写方法写出,注意物质聚集状态和反应的焓变;
D、漏掉钡离子与硫酸根离子生成硫酸钡.
解答 解:A、燃烧热是生成液态水放出的能量,故A错误;
B、N2(g)+3H2(g)?2NH3(g)反应可逆,0.5 mol N2和1.5 molH2置于密闭容器中充分反应,生成NH3的物质的量小于1mol,N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ/mol,故B错误;
C、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol,故C正确;
D、H2SO4和Ba(OH)2反应生成水和硫酸钡,故D错误;
故选:C.
点评 本题考查了燃烧热、中和热概念以及热化学方程式书写,明确概念的内涵是解题关键,题目难度不大.

练习册系列答案
相关题目
15.以下是精确配制一定物质的量浓度NaOH溶液的实验步骤,其中操作正确的有( )


| A. | 1步 | B. | 2步 | C. | 3 | D. | 4步 |
17.在Na2O2和CO2的反应中( )
| A. | Na2O2是氧化剂 | B. | CO2是还原剂 | ||
| C. | Na2O2既是氧化剂又是还原剂 | D. | 此反应中O2是氧化产物 |
14.Al、Fe都是重要的金属元素.下列说法正确的是( )
| A. | 二者对应的氧化物均为碱性氧化物 | |
| B. | 二者的单质都能与强碱溶液反应生成H2 | |
| C. | 二者的氢氧化物均可以通过化合反应直接制备 | |
| D. | 二者的氯化物均可以通化合反应制备 |
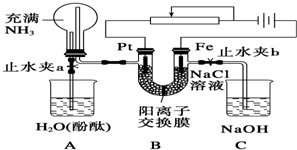
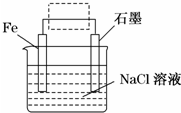 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.(填字母)
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.(填字母)