题目内容
20.三种强碱,A0H、BOH、c(0H)2.其摩尔质量之比为1.0:1.35:1.85.将三种强碱以等物质的量混合,得1.70g混合粉末.这些粉末恰好与2mol/L盐酸20mL完全中和.(1)当三种强碱各以1mol混合时.总质量为170g.
(2)混合粉末中A0H的质量分数为24%.
(3)C的相对原子质量为41.
分析 三种强碱以等物质的量混合,设三种强碱的物质的量都为xmol,所以A0H、BOH、c(0H)2消耗盐酸的物质的量为4xmol,这些粉末恰好与20mol/L盐酸20mL完全中和,所以4x=2mol/L×20×10-3L,则x=0.01mol,因为A0H、BOH、c(0H)2,其摩尔质量分别为ag/mol,1.35ag/mol,1.85ag/mol,而质量为:1.70g,所以0.01(a+1.35a+1.85a)=1.7,所以a=41,所以A0H、BOH、C(0H)2的摩尔质量分别为:41g/mol,55.35g/mol,75.85g/mol,由此分析解答.
解答 解:(1)三种强碱以等物质的量混合,设三种强碱的物质的量都为xmol,所以A0H、BOH、c(0H)2消耗盐酸的物质的量为4xmol,这些粉末恰好与20mol/L盐酸20mL完全中和,所以4x=2mol/L×20×10-3L,则x=0.01mol,所以当三种强碱各以1mol混合时,总质量为1.70g×$\frac{1}{0.01}$=170g,故答案为:170;
(2)合粉末中A0H的质量分数为$\frac{0.01×41}{1.70}×100%$=24%,故答案为:24%;
(3)M(C)=75.85-17×2=41,所以C的相对原子质量为41,故答案为:41.
点评 本题考查物质的量浓度的计算,题目难度中等,解答本题的关键是在学习中能牢固把握相关计算公式,注意答题时能形成清晰的解题思路.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.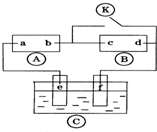 图中
图中 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,下列叙述正确的是( )
后,下列叙述正确的是( )
 图中
图中 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,下列叙述正确的是( )
后,下列叙述正确的是( )| A. | a为直流电源的负极 | B. | d极发生的反应为2H++2e-═H2↑ | ||
| C. | e极发生氧化反应 | D. | f电极为锌板 |
8.下列关于物质分类的说法正确的是( )
| A. | 非金属氧化物均为酸性氧化物 | |
| B. | 冰醋酸、一水合氨、次氯酸都是弱电解质 | |
| C. | 盐酸、硫酸、硝酸都是强电解质 | |
| D. | 液氨、液氯、液体氯化氢都不是电解质 |
15.下列说法正确的是( )
| A. | 在常温常压下,71g Cl2所含原子数为NA | |
| B. | 标准状况下,22.4L氦气中含有的原子数为2NA | |
| C. | 在非标准状况下,1mol任何气体的体积不可能是22.4L | |
| D. | 常温常压下,32g O2和O3混合气体中含有原子数为2NA |
5.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
12.下列说法或表示方法正确的是( )
| A. | 反应物的总能量低于生成物的总能量时,一定不能自发进行反应 | |
| B. | 已知:CH4(g)+$\frac{3}{2}$O2(g)═2H2O(l)+CO(g)△H,则△H表示CH4的燃烧热 | |
| C. | 恒温恒压时,将2 mol A和1 mol B投入密闭容器中,发生反应:2A(g)+B(g)?2C(g),充分反应后测得放出的热量为Q kJ,则该反应的△H=-Q kJ/mol | |
| D. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2 kJ/mol,可知红磷比白磷稳定 |
10.下列说法正确的是( )
| A. | 盐的组成中一定含有金属元素 | |
| B. | 金属一定能与酸反应产生氢气 | |
| C. | 由同种元素组成的纯净物一定是单质 | |
| D. | 同一化合物里同种元素的化合价一定相同 |
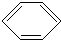 +Cl2
+Cl2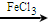
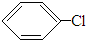 +HCl,反应类型取代反应.
+HCl,反应类型取代反应.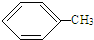 +3HO-NO2
+3HO-NO2
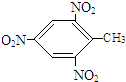 +3H2O,反应类型取代反应.
+3H2O,反应类型取代反应. +3H2
+3H2
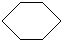 ,反应类型加成反应.
,反应类型加成反应. +Br2
+Br2
 +HBr,反应类型取代.
+HBr,反应类型取代.