题目内容
16.某课外活动小组设计了如图所示的装置,调节滑动变阻器,控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,止水夹a处于打开状态,止水夹b处于关闭状态).实验过程中看到了令人很高兴的现象(阳离子交换膜只允许阳离子和水通过).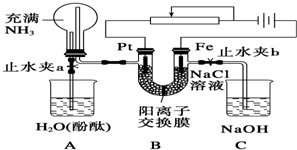
请帮助他们分析并回答下列问题:
(1)写出B装置中的电极反应:
阴极:2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑);阳极:Fe-2e-═Fe2+.
(2)先后观察到A装置中的现象是:
①烧杯A中导管产生气泡数秒后溶液变红,A烧杯中的水倒吸并产生红色喷泉;
②烧瓶中液面上升到高于左侧导管一定程度后又逐渐下落至与导管相平,烧杯A中导管又有气泡冒出.
(3)当观察到A装置中的现象后,他们关闭止水夹a,打开止水夹b.再观察C装置(此溶液经过煮沸,且上层有油膜),若无现象,请说明理由;若有现象,请写出有关反应的化学方程式(是离子反应的写离子方程式):Fe2++2OH-═Fe(OH)2↓;片刻后再向烧杯C中吹大量空气,则C中的现象是白色沉淀迅速变为灰绿色,最后变为红褐色.
分析 (1)用Fe作阳极、Pt作阴极电解饱和食盐水时,阴极上水得电子生成氢气和氢氧根离子,阳极上铁失电子发生氧化反应;
(2)①生成的氢气通过导管进入A中烧瓶,烧瓶内压强增大,打开止水夹a,氨气进入A中烧杯,烧瓶内压强急剧减小,水进入烧瓶中;
②烧瓶中液面上升,当高于左侧导管时,因为压强增大会导致液面下降;
(3)关闭a打开b时,左侧生成的氢气导致U型管内液面左低右高,生成的亚铁离子进入C中生成氢氧化亚铁沉淀;氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀.
解答 解:(1)用Fe作阳极、Pt作阴极电解饱和食盐水时,阴极上水得电子生成氢气和氢氧根离子,阳极上铁失电子发生氧化反应,所以阴极、阳极反应式分别为,
故答案为:2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑);Fe-2e-═Fe2+;
(2)①生成的氢气通过导管进入A中烧瓶,烧瓶内压强增大,打开止水夹a,氨气进入A中烧杯,烧瓶内压强急剧减小,水进入烧瓶中,无色酚酞试液遇碱变红色,所以看到的现象是A烧杯中水倒吸产生红色喷泉,
故答案为:A烧杯中的水倒吸并产生红色喷泉;
②烧瓶中液面上升,当高于左侧导管时,因为压强增大会导致液面下降,最终与导管相平,
故答案为:上升到高于左侧导管一定程度后又逐渐下落至与导管相平;
(3)关闭a打开b时,左侧生成的氢气导致U型管内液面左低右高,生成的亚铁离子进入C中生成氢氧化亚铁沉淀,离子方程式为Fe2++2OH-═Fe(OH)2↓;氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀,所以C中现象为白色沉淀迅速变为灰绿色,最后变为红褐色,
故答案为:Fe2++2OH-═Fe(OH)2↓;白色沉淀迅速变为灰绿色,最后变为红褐色.
点评 本题考查电解原理,为高频考点,涉及电解、喷泉实验、氢氧化亚铁的制备及其性质等知识点,明确各个电极上发生的反应是解本题关键,注意:较活泼金属作阳极时,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.

| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 需要加热的反应说明它是吸热反应 |
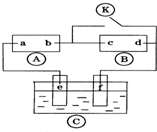 图中
图中 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,下列叙述正确的是( )
后,下列叙述正确的是( )| A. | a为直流电源的负极 | B. | d极发生的反应为2H++2e-═H2↑ | ||
| C. | e极发生氧化反应 | D. | f电极为锌板 |
| A. | 每消耗1 mol C3H8可以向外电路提供12 mol e- | |
| B. | 负极通入C3H8,发生还原反应 | |
| C. | 正极通入氧气和CO2,正极反应式是:O2+2CO2+4e-═2CO32- | |
| D. | CO32-移向电池的正极 |
| A. | 非金属氧化物均为酸性氧化物 | |
| B. | 冰醋酸、一水合氨、次氯酸都是弱电解质 | |
| C. | 盐酸、硫酸、硝酸都是强电解质 | |
| D. | 液氨、液氯、液体氯化氢都不是电解质 |
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |