题目内容
13. (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.(填字母)
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.(填字母)A.C(s)+CO2(g)═2CO(g)△H>0
B.NaOH(aq)+HC1(aq)═NaC1(aq)+H2O(1)△H<0
C.2CO(g)+O2(g)═2CO2(1)△H<0.
(2)钢铁的电化学腐蚀原理,在酸性环境中发生析氢腐蚀,在中性或碱性环境中发生吸氧腐蚀.
①写出图中石墨电极的电极反应式:O2+4e-+2H2O═4OH-.
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在图中虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向.
分析 (1)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
(2)①电解质为NaCl,为中性,发生吸氧腐蚀;
②Fe作电解池的阴极被保护;
③石墨作阳极,氯离子在阳极上失电子;
解答 解:(1)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;
故答案为:C;
(2)①电解质为NaCl,为中性,发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-;
故答案为:O2+4e-+2H2O═4OH-;
②Fe作电解池的阴极被保护,所以给该装置加外接电源,而且负极与铁相连,电子从电源的负极流向铁,其图为 ;
;
故答案为: ;
;
点评 本题考查原电池和电化学腐蚀的电极反应,明确原电池与氧化还原反应的关系及负极发生氧化反应是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
3.如图曲线A和B是盐酸与氢氧化钠溶液的相互滴定的滴定曲线,下列叙述正确的是( )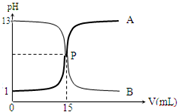

| A. | NaOH溶液的浓度为0.1 mol•L-1 | |
| B. | P点时可能未完全反应,溶液呈可能呈酸性也可能呈碱性 | |
| C. | 曲线A是盐酸滴定氢氧化钠溶液的测定曲线 | |
| D. | 本实验的指示剂不能用甲基橙,只能用酚酞 |
1.2008北京奥运会圆满结束,其中“祥云”火炬燃料是丙烷(C3H8)气体.以丙烷、氧气和CO2及熔融碳酸盐可制作新型燃料电池,电池的总反应式为:C3H8+5O2═3CO2+4H2O.下列说法正确的是( )
| A. | 每消耗1 mol C3H8可以向外电路提供12 mol e- | |
| B. | 负极通入C3H8,发生还原反应 | |
| C. | 正极通入氧气和CO2,正极反应式是:O2+2CO2+4e-═2CO32- | |
| D. | CO32-移向电池的正极 |
8.下列关于物质分类的说法正确的是( )
| A. | 非金属氧化物均为酸性氧化物 | |
| B. | 冰醋酸、一水合氨、次氯酸都是弱电解质 | |
| C. | 盐酸、硫酸、硝酸都是强电解质 | |
| D. | 液氨、液氯、液体氯化氢都不是电解质 |
18.下列说法或表述中正确的是( )
| A. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| B. | 淀粉、油脂、蛋白质、纤维素都能在人体内水解,也能在体内氧化提供能量 | |
| C. |  如图所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
5.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
2.下列各组离子中,能在溶液中大量共存的是( )
| A. | H+ Na+CO32- Cl- | B. | Mg2+ Na+Cl- SO42- | ||
| C. | K+ NH4+ SO42-OH- | D. | Fe2+ Al3+ NO3-H+ |
3.下列说法正确的是( )
| A. | 1 mol氧为32 g | |
| B. | 标准状况下,1 mol H2和O2的混合气体的体积约为22.4 L | |
| C. | CO2的摩尔质量为44 | |
| D. | 2 mol•L-1的BaCl2溶液中含Cl-的个数为2.408×1024 |