题目内容
15.以下是精确配制一定物质的量浓度NaOH溶液的实验步骤,其中操作正确的有( )
| A. | 1步 | B. | 2步 | C. | 3 | D. | 4步 |
分析 氢氧化钠为腐蚀品,应放在小烧杯中称量;
移液时应用玻璃棒引流;
定容时,离刻度线1-2cm后,应用胶头滴管逐滴滴加;
摇匀前应盖上瓶塞.
解答 解:氢氧化钠为腐蚀品,应放在小烧杯中称量,故Ⅰ错误;
移液时应用玻璃棒引流,故Ⅲ和Ⅴ错误;
定容时,离刻度线1-2cm后,应用胶头滴管逐滴滴加,故Ⅵ错误;
摇匀前应盖上瓶塞,故.VⅡ错误;
溶解时应用玻璃棒不断搅拌,且冷却后再移液,故Ⅱ正确;
移液后应用蒸馏水洗涤玻璃棒和烧杯2-3次,故Ⅳ正确;
所以正确的操作为Ⅱ和Ⅳ;
故选:B.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制的正确操作步骤是解题关键,题目难度不大.

练习册系列答案
相关题目
5.饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质.A、B、C、D、E五种常见化合物都是由下表中的离子形成:
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3;D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═[Al(OH)4]-.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3;D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═[Al(OH)4]-.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
3.如图曲线A和B是盐酸与氢氧化钠溶液的相互滴定的滴定曲线,下列叙述正确的是( )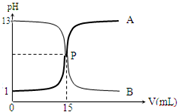

| A. | NaOH溶液的浓度为0.1 mol•L-1 | |
| B. | P点时可能未完全反应,溶液呈可能呈酸性也可能呈碱性 | |
| C. | 曲线A是盐酸滴定氢氧化钠溶液的测定曲线 | |
| D. | 本实验的指示剂不能用甲基橙,只能用酚酞 |
20.常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3•H2O溶液.下列说法正确的是( )
| A. | 同物质的量浓度的三种溶液的pH:a=b>c | |
| B. | 同pH时,三种溶液稀释相同倍数后,pH:a=b<c | |
| C. | 同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c | |
| D. | 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
7.下列有关热化学方程式的叙述正确的是( )
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 需要加热的反应说明它是吸热反应 |
5.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
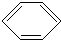 +Cl2
+Cl2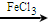
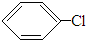 +HCl,反应类型取代反应.
+HCl,反应类型取代反应.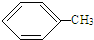 +3HO-NO2
+3HO-NO2
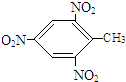 +3H2O,反应类型取代反应.
+3H2O,反应类型取代反应. +3H2
+3H2
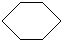 ,反应类型加成反应.
,反应类型加成反应. +Br2
+Br2
 +HBr,反应类型取代.
+HBr,反应类型取代.