题目内容
15.下列对分子及其性质的解释中,不正确的是( )| A. | 液态氟化氢分子间存在氢键,所以氟化氢的沸点比氯化氢高 | |
| B. | CH4、CO2、C2H2都是含有极性键的非极性分子 | |
| C. | [Cu(NH3)4]2+中含有离子键、极性键、配位键 | |
| D. | 因为非羟基氧原子数目逐渐减少,所以酸性HClO4>H2SO4>H3PO4 |
分析 A、F的电负性大,HF分子间存在氢键;
B.分子结构对称,正负电荷中心重叠的分子属于非极性分子;
C、[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键;
D、非羟基氧原子数目越多酸性越强.
解答 解A、氟化氢的沸点高于氯化氢,是因HF分子间存在氢键,而HCl分子间几乎不存在氢键,故A正确;
B.CO2、C2H2和CH4分子中含有极性共价键,分子结构对称,正负电荷中心重叠的分子属于非极性分子,故B正确;
C、[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,无离子键,故C错误;
D、非羟基氧原子数目越多酸性越强,而在HClO4中3个非非羟基氧原子,H2SO4中2个非非羟基氧原子,H3PO4中1个非非羟基氧原子,所以酸性强弱的顺序为:HClO4>H2SO4>H3PO4,故D正确;
故选C.
点评 本题考查较为综合,涉及晶体的氢键、分子的极性等知识,侧重于学生的分析能力的考查,注意把握元素周期律的递变规律,难度中等,学习中注意积累.

练习册系列答案
相关题目
5.下列反应过程中的能量变化与如图相符的是( )


| A. | 金属钠和水反应 | B. | 生石灰变成熟石灰的反应 | ||
| C. | Al和Fe2O3的铝热反应 | D. | CaCO3受热分解 |
6.如图为冰的一种骨架形式,依此为单位向空间延伸,请问该冰中的每个水分子有几个氢键( )
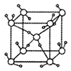

| A. | 2 | B. | 4 | C. | 8 | D. | 1 |
3.在N2+3H2?2NH3的可逆反应中,自反应开始至2s末,氨的浓度由0变为0.8 mol•L-1 则以氢气的浓度变化表示该反应在2s内的平均反应速率是( )
| A. | 0.3 mol•L-1•S-1 | B. | 0.4 mol•L-1•S-1 | C. | 0.6mol•L-1•S-1 | D. | 0.8 mol•L-1•S-1 |
20.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝.关于${\;}_{116}^{203}$Lv的叙述错误的是( )
| A. | 原子序数116 | B. | 中子数177 | C. | 核外电子数116 | D. | 质子数177 |
20.乙烯的相关转化关系如图,下列说法正确的是( )
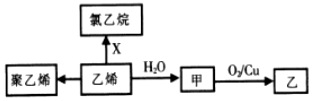

| A. | 1mol聚乙烯含有的原子数目为6NA | B. | CH3OCH3与甲互为同分异构体 | ||
| C. | X为C12 | D. | 甲→乙反应类型为取代反应 |
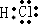 ,X2Y的结构式
,X2Y的结构式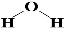 .
.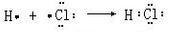 .
.