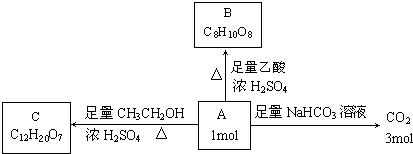
题目内容
现有部分前四周期元素的性质或原子结构如下表:
(1)元素X的原子最外层共有 种不同运动状态的电子.
(2)Y的单质分子中所含有的化学键类型(填重叠方式)为 ;通常情况下,该分子的化学性质稳定,其原因是 .
(3)从下列选项中选出Y的基态原子的最外层原子轨道表示式 ,另一原子轨道表示式不能作为基态原子的轨道表示式是因为它不符合 .(填序号).

(4)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 .
a、常温下Z的单质和T的单质状态不同
b、Z的氢化物比T的氢化物稳定
c、一定条件下,单质Z能将单质T从其氢化物中置换出来
(5)元素W与元素Z形成的化合物的化学式可以为 (用元素符号表示).
(6)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中物理性质明显不同于其他三种酸的是 ,理由是 .
| 元素编号 | 元素性质或原子结构 |
| T | M层上有3个未成对电子 |
| X | 3p能级上有一个空轨道 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 3d能级上只有1对成对电子 |
(2)Y的单质分子中所含有的化学键类型(填重叠方式)为
(3)从下列选项中选出Y的基态原子的最外层原子轨道表示式

(4)元素Z与元素T相比,非金属性较强的是
a、常温下Z的单质和T的单质状态不同
b、Z的氢化物比T的氢化物稳定
c、一定条件下,单质Z能将单质T从其氢化物中置换出来
(5)元素W与元素Z形成的化合物的化学式可以为
(6)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中物理性质明显不同于其他三种酸的是
考点:位置结构性质的相互关系应用,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:T的M层上有3个未成对电子,则M含有3个电子层,最外层含有5个电子,M为P元素;
X元素的3p能级上有一个空轨道,根据能量最低原理,基态原子核外电子排布为:1s22s22p63s23p2,则X为Si元素;
Y元素的常温下单质为双原子分子,其氢化物水溶液呈碱性,该氢化物为氨气,则Y为N元素;
Z元素最高正价是+7价,则最外层含有7个电子,为Cl或Br元素;
W的3d能级上只有1对成对电子,则W的3d轨道含有6个电子,W的基态原子电子排布式为:1s22s22p63s23p64s23d6,W的原子序数为26,为Fe元素,据此进行解答.
X元素的3p能级上有一个空轨道,根据能量最低原理,基态原子核外电子排布为:1s22s22p63s23p2,则X为Si元素;
Y元素的常温下单质为双原子分子,其氢化物水溶液呈碱性,该氢化物为氨气,则Y为N元素;
Z元素最高正价是+7价,则最外层含有7个电子,为Cl或Br元素;
W的3d能级上只有1对成对电子,则W的3d轨道含有6个电子,W的基态原子电子排布式为:1s22s22p63s23p64s23d6,W的原子序数为26,为Fe元素,据此进行解答.
解答:
解:T的M层上有3个未成对电子,则M含有3个电子层,最外层含有5个电子,M为P元素;X元素的3p能级上有一个空轨道,根据能量最低原理,基态原子核外电子排布为:1s22s22p63s23p2,则X为Si元素;Y元素的常温下单质为双原子分子,其氢化物水溶液呈碱性,该氢化物为氨气,则Y为N元素;Z元素最高正价是+7价,则最外层含有7个电子,为Cl或Br;W的3d能级上只有1对成对电子,则W的3d轨道含有6个电子,W的基态原子电子排布式为:1s22s22p63s23p64s23d6,W的原子序数为26,为Fe元素
(1)X为Si,核外有14个电子,则有14种不同运动状态的电子,
故答案为:14;
(2)Y为N元素,其单质为氮气,氮气中存在氮氮三键,其中1个为p-pσ键、2个p-pπ键;由于氮氮三键键能比较大,键比较牢固,所以化学性质稳定,
故答案为:p-pσ键、p-pπ键;氮氮三键键能大,键比较牢固;
(3)Y为N元素,氮原子最外层含有5个电子,基态原子的最外层原子轨道表示式为: ,所以B正确;
,所以B正确;
2p轨道的3个电子优先占据一个轨道,A违反洪特规则,所以D正确,
故答案为:B;D;
(4)非金属性:Cl(或Br)>S,
a.常温下Z的单质和T的单质状态不同,不能利用状态来判断非金属性的关系,故a错误;
b.Z的氢化物比T的氢化物稳定,则非金属性Z>T,故b正确;
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应,只能说明都具有非金属性,但无法比较强弱,故c错误;
故答案为:Cl(或Br);b;
(5)元素W与元素Z形成的化合物为氯化铁、氯化亚铁或溴化铁、溴化亚铁,其化学式可以为:FeCl2、FeCl3或
FeBr2、FeBr3,
故答案为:FeCl2、FeCl3(或FeBr2、FeBr3);
(6)T、X、Y、Z四种元素的最高价氧化物水化物分别为H2SO4、H2CO3、HNO3、HClO4(或HBrO4),只有H2CO3为弱酸,其余为强酸,
故答案为:H2CO3;H2CO3为弱酸性或非氧化性酸.
(1)X为Si,核外有14个电子,则有14种不同运动状态的电子,
故答案为:14;
(2)Y为N元素,其单质为氮气,氮气中存在氮氮三键,其中1个为p-pσ键、2个p-pπ键;由于氮氮三键键能比较大,键比较牢固,所以化学性质稳定,
故答案为:p-pσ键、p-pπ键;氮氮三键键能大,键比较牢固;
(3)Y为N元素,氮原子最外层含有5个电子,基态原子的最外层原子轨道表示式为:
 ,所以B正确;
,所以B正确;2p轨道的3个电子优先占据一个轨道,A违反洪特规则,所以D正确,
故答案为:B;D;
(4)非金属性:Cl(或Br)>S,
a.常温下Z的单质和T的单质状态不同,不能利用状态来判断非金属性的关系,故a错误;
b.Z的氢化物比T的氢化物稳定,则非金属性Z>T,故b正确;
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应,只能说明都具有非金属性,但无法比较强弱,故c错误;
故答案为:Cl(或Br);b;
(5)元素W与元素Z形成的化合物为氯化铁、氯化亚铁或溴化铁、溴化亚铁,其化学式可以为:FeCl2、FeCl3或
FeBr2、FeBr3,
故答案为:FeCl2、FeCl3(或FeBr2、FeBr3);
(6)T、X、Y、Z四种元素的最高价氧化物水化物分别为H2SO4、H2CO3、HNO3、HClO4(或HBrO4),只有H2CO3为弱酸,其余为强酸,
故答案为:H2CO3;H2CO3为弱酸性或非氧化性酸.
点评:本题考查了位置结构与性质关系的综合应用,题目难度中等,试题知识点较多、综合性较强,正确推断各元素名称为解答关键,注意掌握常见原子结构、元素周期表结构及元素周期律内容,试题有利于培养学生的分析、理解能力.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
下列说法正确的是( )
| A、将浓度为0.1mol?L-1HF溶液加水不断稀释过程中,c(H+)和c(OH-)都会减小 |
| B、常温下,为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的PH,若PH>7,则H2A是弱酸;若PH<7,则H2A是强酸 |
| C、将SO2通入一定量的KOH溶液,所得溶液呈中性,该溶液中一定含KHSO2 |
| D、用0.2000mol?L-1NaOH标准溶液滴定浓度均为0.1mol?L-1的HCl与CH3COOH的混合液,至中性时,溶液中的酸恰好被完全中和 |
关于硅及其化合物的叙述中,不正确的是( )
| A、硅酸凝胶干燥后可作实验室、袋装食品和瓶装药品的干燥剂 |
| B、硅可做半导体材料 |
| C、二氧化硅是现代光学及光纤制品的基本原料 |
| D、碳化硅是做电子组件的材料 |