题目内容
在0.050L b mol/L的 AlCl3溶液里,加入0.050L a mol/L的NaOH 溶液.
(1)a≤3b时,生成Al(OH)3沉淀的质量是 ;
(2)当3b<a<4b时,生成Al(OH)3沉淀的质量是 ;
(3)当a≥4b时,生成Al(OH)3沉淀的质量是 .
(1)a≤3b时,生成Al(OH)3沉淀的质量是
(2)当3b<a<4b时,生成Al(OH)3沉淀的质量是
(3)当a≥4b时,生成Al(OH)3沉淀的质量是
考点:化学方程式的有关计算
专题:
分析:AlCl3 +3NaOH=Al(OH)3↓+3NaCl
1 3
0.05b 0.05a
AlCl3 +4NaOH=NaAlO2+2H2O
1 4
0.05b 0.05a
当a=3b时刚好完全沉淀,a=4b时刚好无沉淀生成,
所以①a≥4b时无沉淀产生,
②3b<a<4b时,先有沉淀产生后部分溶解,
在向AlCl3溶液中加入NaOH溶液时,会生成白色沉淀Al(OH)3并逐渐增多,一段时间后又逐渐减小,直至全部消失,因为Al(OH)3会继续与OH-反应生成溶于水的AlO2-离子.
1 3
0.05b 0.05a
AlCl3 +4NaOH=NaAlO2+2H2O
1 4
0.05b 0.05a
当a=3b时刚好完全沉淀,a=4b时刚好无沉淀生成,
所以①a≥4b时无沉淀产生,
②3b<a<4b时,先有沉淀产生后部分溶解,
在向AlCl3溶液中加入NaOH溶液时,会生成白色沉淀Al(OH)3并逐渐增多,一段时间后又逐渐减小,直至全部消失,因为Al(OH)3会继续与OH-反应生成溶于水的AlO2-离子.
解答:
解:AlCl3 +3NaOH=Al(OH)3↓+3NaCl
1 3
0.05b 0.05a
AlCl3 +4NaOH=NaAlO2+2H2O
1 4
0.05b 0.05a
当a=3b时刚好完全沉淀,a=4b时刚好无沉淀生成,
(1)当a≤3b时,NaOH不足,NaOH完全反应生成Al(OH)3 沉淀,
生成Al(OH)3的物质的量为:n(Al(OH)3)=
n(NaOH)=0.05×
mol,则氢氧化铝的质量为:0.05×
mol×78g/mol=1.3ag;
故答案为:1.3ag;
(2)由反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl、AlCl3+4NaOH=NaAlO2+2H2O,
可知:3b<a<4b时,先有沉淀产生后部分溶解,则
AlCl3+3 NaOH=Al(OH)3↓+3NaCl
0.05b 0.15b 0.05b
Al(OH)3↓+NaOH=NaAlO2+2H2O
1 1
(0.05a-0.15b) (0.05a-0.15b)
所以最后剩余n(Al(OH)3 )=[0.05b-(0.05a-0.15b)]mol=(0.2b-0.05a)mol,
m(Al(OH)3 )=(0.2b-0.05a)mol×78g/mol=78×(0.2b-0.05a)g=(15.6b-1.3a)g
故答案为:(15.6b-1.3a)g;
(3)由反应AlCl3+4NaOH=NaAlO2+2H2O可知,a≥4b时无沉淀产生,则沉淀的质量为0g,故答案为:0g.
1 3
0.05b 0.05a
AlCl3 +4NaOH=NaAlO2+2H2O
1 4
0.05b 0.05a
当a=3b时刚好完全沉淀,a=4b时刚好无沉淀生成,
(1)当a≤3b时,NaOH不足,NaOH完全反应生成Al(OH)3 沉淀,
生成Al(OH)3的物质的量为:n(Al(OH)3)=
| 1 |
| 3 |
| a |
| 3 |
| a |
| 3 |
故答案为:1.3ag;
(2)由反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl、AlCl3+4NaOH=NaAlO2+2H2O,
可知:3b<a<4b时,先有沉淀产生后部分溶解,则
AlCl3+3 NaOH=Al(OH)3↓+3NaCl
0.05b 0.15b 0.05b
Al(OH)3↓+NaOH=NaAlO2+2H2O
1 1
(0.05a-0.15b) (0.05a-0.15b)
所以最后剩余n(Al(OH)3 )=[0.05b-(0.05a-0.15b)]mol=(0.2b-0.05a)mol,
m(Al(OH)3 )=(0.2b-0.05a)mol×78g/mol=78×(0.2b-0.05a)g=(15.6b-1.3a)g
故答案为:(15.6b-1.3a)g;
(3)由反应AlCl3+4NaOH=NaAlO2+2H2O可知,a≥4b时无沉淀产生,则沉淀的质量为0g,故答案为:0g.
点评:本题考查化学方程式的相关计算,题目难度中等,注意根据反应的方程式结合物质的物质的量进行计算.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
将过量的二氧化碳通入下列溶液中,最终会出现浑浊的是( )
| A、氯化钙溶液 | B、澄清的石灰水 |
| C、水玻璃 | D、硝酸钡溶液 |
下列用来表示物质变化的化学用语中,正确的是( )
| A、NH4NO3溶液呈酸性的原因:NH4++H2O=NH3?H2O+H+ |
| B、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ |
| C、硫酸氢钠溶液中滴加少量Ba(OH)2溶液的离子方程式:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
D、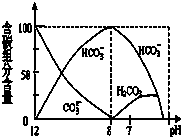 如图是在0.1 mol?L-1Na2CO3溶液中逐滴加入0.1 mol?L-1 HCl,则 pH=7时的离子方程式:H++HCO3-=CO2↑+H2O |
 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入Fe粉,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如如图所示.则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入Fe粉,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如如图所示.则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )| A、1:1:1 |
| B、1:1:4 |
| C、1:2:2 |
| D、3:2:8 |
某一有机物A(C8H16O2)可发生如图变化;已知B为羧酸,且D氧化可以得到B,则A的可能结构有( )


| A、1种 | B、2种 | C、3种 | D、4种 |
