题目内容
下列说法正确的是( )
| A、将浓度为0.1mol?L-1HF溶液加水不断稀释过程中,c(H+)和c(OH-)都会减小 |
| B、常温下,为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的PH,若PH>7,则H2A是弱酸;若PH<7,则H2A是强酸 |
| C、将SO2通入一定量的KOH溶液,所得溶液呈中性,该溶液中一定含KHSO2 |
| D、用0.2000mol?L-1NaOH标准溶液滴定浓度均为0.1mol?L-1的HCl与CH3COOH的混合液,至中性时,溶液中的酸恰好被完全中和 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A、一定温度下的溶液中存在离子积常数,氢氧根离子浓度和氢离子浓度乘积为常数;
B、NaHA溶液若PH>7说明溶液呈碱性,说明对应酸一定为弱酸,若pH<7可能对应酸是强酸,也可能对应酸是弱酸;
C、将SO2通入一定量KOH溶液,所得溶液呈中性,氢离子浓度等于氢氧根离子浓度,依据电荷守恒分析判断,c(H+)+c(K+)=c(OH-)+c(HSO3-)+2c(SO32-),该溶液中一定含KHSO3 ;
D、氢氧化钠溶液滴定盐酸溶液至中性,溶液中酸恰好反应,滴定醋酸时,醋酸恰好反应时生成醋酸钠,溶液呈碱性.
B、NaHA溶液若PH>7说明溶液呈碱性,说明对应酸一定为弱酸,若pH<7可能对应酸是强酸,也可能对应酸是弱酸;
C、将SO2通入一定量KOH溶液,所得溶液呈中性,氢离子浓度等于氢氧根离子浓度,依据电荷守恒分析判断,c(H+)+c(K+)=c(OH-)+c(HSO3-)+2c(SO32-),该溶液中一定含KHSO3 ;
D、氢氧化钠溶液滴定盐酸溶液至中性,溶液中酸恰好反应,滴定醋酸时,醋酸恰好反应时生成醋酸钠,溶液呈碱性.
解答:
解:A、一定温度下的溶液中存在离子积常数,氢氧根离子浓度和氢离子浓度乘积为常数,将浓度为0.1mol?L-1 HF溶液加水不断稀释过程中,c( H+) 会减小,c( OH-)离子浓度增大,故A错误;
B、NaHA溶液若pH>7说明溶液呈碱性,说明对应酸一定为弱酸,若pH<7可能对应酸是强酸,如硫酸氢钠,也可能对应酸是弱酸,如亚硫酸氢钠,故B错误;
C、依据溶液中电荷守恒,c(H+)+c(K+)=c(OH-)+c(HSO3-)+2c(SO32-),溶液呈中性c(H+)=c(OH-),c(K+)=c(HSO3-)+2c(SO32-),所以溶液中一定存在KHSO3 ,故C正确;
D、用0.200mol?L-1 NaOH标准溶液滴定浓度均为0.1mol?L-1 的HCl与CH3COOH的混合液,至中性时,盐酸溶液恰好完全中和,滴定醋酸时,醋酸恰好反应时生成醋酸钠,溶液呈碱性,醋酸略有剩余,故D错误;
故选C.
B、NaHA溶液若pH>7说明溶液呈碱性,说明对应酸一定为弱酸,若pH<7可能对应酸是强酸,如硫酸氢钠,也可能对应酸是弱酸,如亚硫酸氢钠,故B错误;
C、依据溶液中电荷守恒,c(H+)+c(K+)=c(OH-)+c(HSO3-)+2c(SO32-),溶液呈中性c(H+)=c(OH-),c(K+)=c(HSO3-)+2c(SO32-),所以溶液中一定存在KHSO3 ,故C正确;
D、用0.200mol?L-1 NaOH标准溶液滴定浓度均为0.1mol?L-1 的HCl与CH3COOH的混合液,至中性时,盐酸溶液恰好完全中和,滴定醋酸时,醋酸恰好反应时生成醋酸钠,溶液呈碱性,醋酸略有剩余,故D错误;
故选C.
点评:本题考查了弱电解质电离平衡的应用判断,盐类水解的应用,溶液中电荷守恒的分析,酸碱中和溶液酸碱性的分析理解,题目难度中等.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
微观粒子是化学研究的主要对象.若阿伏加德罗常数为6.02×1023mol-1,下列对粒子数判断正确的是( )
| A、常温常压下,2.24L H2O2气体中含有的分子数为0.1×6.02×1023 |
| B、46 g NO2和N2O4混合气体中含有原子数为3NA |
| C、100 mL 0.2 mol/L的Fe2(SO4)3溶液中,含有的Fe3+数为0.1×0.2×6.02×1023 |
| D、25℃时,纯水中含有的H+数为1×10-7×6.02×1023 |
酸性KMnO4溶液是化学实验中的一种常用强氧化剂.下列溶液中肯定不能用于酸化KMnO4溶液的是( )
| A、HNO3 |
| B、NaHSO4 |
| C、H2SO4 |
| D、HCl |
关于以下两个电解装置的说法正确的是( )


| A、两个装置中阳极都为Al,接通电源后,均失电子发生还原反应 |
| B、两装置中阴极都为C,但由于电解质溶液不同,阴极放电离子种类不同 |
| C、电解一段时间后,撤去电源与电极,充分振荡烧杯后,甲中有白色沉淀,乙中没有 |
| D、电解过程中两装置pH均不变 |

 现有部分前四周期元素的性质、原子结构如下表:
现有部分前四周期元素的性质、原子结构如下表: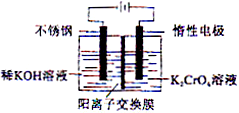 (1)Na2SO3和Na2S是硫元素的两种重要化合物,请回答下列问题:
(1)Na2SO3和Na2S是硫元素的两种重要化合物,请回答下列问题: