题目内容
2.R为1~18号元素,其原子所具有的电子层数为最外层电子数的$\frac{1}{2}$,它可能形成的含氧酸根离子有:①RO32-,②RO42-,③R2O32-,下列叙述判断正确的是( )| A. | 当它可以形成①时,不可能形成③ | B. | 当它形成①时,也可以形成②和③ | ||
| C. | 当它可以形成②时,不可能形成③ | D. | 当它可以形成①时,不可能形成② |
分析 R为1~18号元素,其原子所具有的电子层数为最外层电子数的$\frac{1}{2}$,若R的电子层为1,则核外电子数为2,为He元素,He性质稳定,没有含氧酸根;若R的电子层为2,则最外层电子数为4,为C元素;若R的电子层为3,则最外层电子数为6,为S元素,以此解答该题.
解答 解:R为1~18号元素,其原子所具有的电子层数为最外层电子数的$\frac{1}{2}$,若R的电子层为1,则核外电子数为2,为He元素,He性质稳定,没有含氧酸根;若R的电子层为2,则最外层电子数为4,为C元素;若R的电子层为3,则最外层电子数为6,为S元素,
A.当它可以形成①时,可为SO32-,可能形成S2 O32-,故A错误;
B.当它形成①时,可为SO32-,也可以形成S2 O32-和SO42-,故B正确;
C.当它可以形成②时,可为SO42-,可形成S2 O32-,故C错误;
D.当它可以形成①时,可为SO32-,可形成SO42-,故D错误.
故选B.
点评 本题考查原子结构、性质、位置关系等,为高频考点,侧重于学生的分析能力的考查,难度中等,学生对草酸根、硫代硫酸根比较陌生,清楚C、S元素的含氧酸根是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.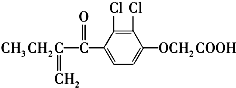 利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:
利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:
下列叙述正确的是( )
 利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:
利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:下列叙述正确的是( )
| A. | 利尿酸分子内处于同一平面的原子数不超过10个 | |
| B. | 利尿酸的衍生物利尿酸甲酯的分子式是C14H14Cl2O4 | |
| C. | 该有机物有4种官能团 | |
| D. | 利尿酸能与FeCl3溶液发生显色反应 |
10.必须加入氧化剂才能实现的变化是( )
| A. | MnO4-→Mn2+ | B. | NaOH→NaCl | C. | Na2SO3→SO2 | D. | CO→CO2 |
17.下列叙述中正确的是( )
| A. | 含5个碳原子的有机物,每个分子中最多可形成4个C-C键 | |
| B. | 正戊烷分子中所有原子均在一条直线上 | |
| C. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定符合通式CnH2n+2 | |
| D. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 |
7.下列物质中既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②AlCl3 ③Al2O3 ④Al(OH)3 ⑤Al.
①NaHCO3 ②AlCl3 ③Al2O3 ④Al(OH)3 ⑤Al.
| A. | ③④ | B. | ③④⑤ | C. | ①③④⑤ | D. | 全部 |
11.阿伏加德罗常数的值为NA,下列说法中正确的是( )
| A. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| B. | 1mol 固体Na2O2含有的阴阳离子总数为3NA | |
| C. | 等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1 | |
| D. | 1L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA |
12.在一定量的密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g).已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L.当反应达到平衡时,可能存在的数据是( )
| A. | N2、H2均为0.18mol/L | B. | N2为0.15mol/L | ||
| C. | N2为0.2mol/L,H2为0.6mol/L | D. | NH3为0.4mol/L |
 化钙溶液与碳酸氢镁溶液反应:HCO3—+Ca2++OH—=CaCO3↓+H2O
化钙溶液与碳酸氢镁溶液反应:HCO3—+Ca2++OH—=CaCO3↓+H2O 3++NO↑+2H2O
3++NO↑+2H2O 铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.
铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.