题目内容
17.下列叙述中正确的是( )| A. | 含5个碳原子的有机物,每个分子中最多可形成4个C-C键 | |
| B. | 正戊烷分子中所有原子均在一条直线上 | |
| C. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定符合通式CnH2n+2 | |
| D. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 |
分析 A、根据碳原子可以形成碳链,也可以形成碳环,可以带支链,也可以不带支链来解答;
B、根据甲烷是正四面体结构判断正戊烷的结构;
C、环烷烃中只含有C-C单键与C-H单键;
D、满足通式为CnH2n+2的有机物是烷烃,互为同系物.
解答 解:A、碳原子可以形成碳链,无论带支链,还是不带支链,都含有4个C-C单键;碳原子可以形成碳环,可以带支链,也可以不带支链,都含有5个C-C单键,故A错误;
B、正戊烷分子中,甲基中的原子是立体结构,正戊烷也是立体结构的有机物,所以正戊烷分子中所有原子在一条直线上是错误的,故B错误;
C、不仅饱和链烃中只含有C-C单键与C-H单键,环烷烃中也只含有C-C单键与C-H单键,故C错误;
D、满足通式为CnH2n+2的有机物是烷烃,互为同系物,所以分子式为C3H8与C6H14的两种有机物一定互为同系物,故D正确;
故选D.
点评 本题考查了有机物的成键特征、有机物的结构、同系物的概念等知识,侧重于基础知识的考查,注意对重要有机物的结构及性质的把握.

练习册系列答案
相关题目
8.含有一个三键的炔烃、加氢后的产物结构简式为: ,这种炔烃的名称为( )
,这种炔烃的名称为( )
 ,这种炔烃的名称为( )
,这种炔烃的名称为( )| A. | 5-甲基-3-乙基-1-己炔 | B. | 5-甲基-3-乙基-2-己炔 | ||
| C. | 4-甲基-5-乙基-2-己炔 | D. | 2-甲基-4-乙基-5-己炔 |
5.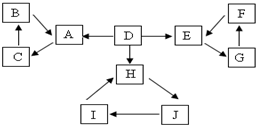 A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:
A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:
用化学用语回答下列问题:
(1)A、E、H中原子序数最大的元素的元素符号S,A、B、C共同含有的元素在周期表中的位置第三周期第IIIA族;
(2)指出H中化学键类型离子键和共价键,写出与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的电子式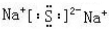 .
.
(3)常温下C溶液的PH<7,(填“<”、“>”或“=”)写出C溶液中通入少量盐酸生成B的化学方程式HCl+NaAlO2+H2O=Al(OH)3↓+NaCl.写出C溶液中滴加NaHCO3溶液的离子方程式AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-.
(4)Zn和Cu分别和一定量F的浓溶液反应,若产生的气体体积相等(相同条件下),则下列判断正确的是BD
A.产生的气体种类一定相同 B.转移的电子一定相同
C.消耗F的物质的量一定相同 D.消耗两种金属物质的量一定相同
(5)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定浓度的苛性钾溶液中,两者恰好完全反应,生成三种含Y元素的离子,其中YO3-、YO-两种离子物质的量之比为1:2,该反应的离子方程式是10OH-+5Cl2=2ClO-+ClO3-+7Cl-+5 H2O.
 A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:
A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:| 编号 | 信息 | 编号 | 信息 |
| 1 | D为地壳中含量最高的元素组成的单质 | 4 | H为淡黄色固体化合物 |
| 2 | E为酸性气态氧化物 | 5 | 电解饱和J溶液是工业重要反应 |
| 3 | F的浓溶液常做干燥剂 | 6 | C为离子化合物,阴、阳离子均含金属元素 |
(1)A、E、H中原子序数最大的元素的元素符号S,A、B、C共同含有的元素在周期表中的位置第三周期第IIIA族;
(2)指出H中化学键类型离子键和共价键,写出与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的电子式
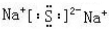 .
.(3)常温下C溶液的PH<7,(填“<”、“>”或“=”)写出C溶液中通入少量盐酸生成B的化学方程式HCl+NaAlO2+H2O=Al(OH)3↓+NaCl.写出C溶液中滴加NaHCO3溶液的离子方程式AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-.
(4)Zn和Cu分别和一定量F的浓溶液反应,若产生的气体体积相等(相同条件下),则下列判断正确的是BD
A.产生的气体种类一定相同 B.转移的电子一定相同
C.消耗F的物质的量一定相同 D.消耗两种金属物质的量一定相同
(5)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定浓度的苛性钾溶液中,两者恰好完全反应,生成三种含Y元素的离子,其中YO3-、YO-两种离子物质的量之比为1:2,该反应的离子方程式是10OH-+5Cl2=2ClO-+ClO3-+7Cl-+5 H2O.
2.R为1~18号元素,其原子所具有的电子层数为最外层电子数的$\frac{1}{2}$,它可能形成的含氧酸根离子有:①RO32-,②RO42-,③R2O32-,下列叙述判断正确的是( )
| A. | 当它可以形成①时,不可能形成③ | B. | 当它形成①时,也可以形成②和③ | ||
| C. | 当它可以形成②时,不可能形成③ | D. | 当它可以形成①时,不可能形成② |
6.电解法制取有广泛用途的Na2FeO4,同时获得氢气.工作原理如图1所示,c( Na2FeO4)随初始c(NaOH)的变化如图2.
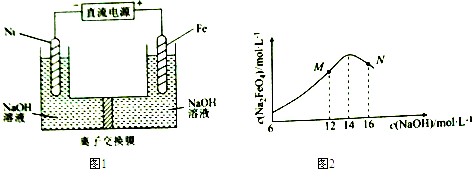
已知:FeO42-为紫红色;Na2FeO4只在强碱性条件下稳定,易被H2还原;溶液中OH-浓度过高,铁电极区会产生红褐色物质.下列说法错误的是( )

已知:FeO42-为紫红色;Na2FeO4只在强碱性条件下稳定,易被H2还原;溶液中OH-浓度过高,铁电极区会产生红褐色物质.下列说法错误的是( )
| A. | 制备Na2FeO4的电极反应为Fe-6e-+8OH-=FeO42-+4H2O | |
| B. | 电解过程中,须将阴极产生的气体及时排出 | |
| C. | MN两点中c(Na2FeO4)低于最高值的原因不同,在M点会有Fe(OH)3生成 | |
| D. | 图1中的离子交换膜为阴离子交换膜,电解过程中,阴极区附近pH会增大 |
 念出发,下列实验不宜用图7所示装置进行的是
念出发,下列实验不宜用图7所示装置进行的是
 2,3-二甲基戊烷
2,3-二甲基戊烷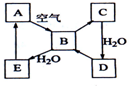 下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料. .
.