题目内容
10.必须加入氧化剂才能实现的变化是( )| A. | MnO4-→Mn2+ | B. | NaOH→NaCl | C. | Na2SO3→SO2 | D. | CO→CO2 |
分析 必须加入氧化剂才能实现,则选项中为还原剂发生的氧化反应,还原剂中某元素的化合价升高,以此来解答.
解答 解:A.MnO4-→Mn2+中Mn元素的化合价降低被还原,需要加入还原剂,故A错误;
B.NaOH→NaCl中没有元素的化合价变化,不需要加氧化剂,故B错误;
C.Na2SO3→SO2中没有元素的化合价变化,不需要加氧化剂,故C错误;
D.CO→CO2中C元素的化合价升高,需要加氧化剂实现,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.你认为减少酸雨产生的途径可采取的措施是( )
①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新的能源.
①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新的能源.
| A. | ②③ | B. | ②③④⑤ | C. | ①③⑤ | D. | ①③④⑤ |
18.物质的变化千奇百怪,但概括起来就两大类,即物理变化和化学变化,下列说法正确的是( )
| A. | 有化学键破坏的变化一定属于化学变化 | |
| B. | 发生了颜色变化的一定是化学变化 | |
| C. | 有气泡产生或沉淀析出的变化一定是化学变化 | |
| D. | 燃烧一定是化学变化 |
5.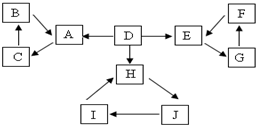 A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:
A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:
用化学用语回答下列问题:
(1)A、E、H中原子序数最大的元素的元素符号S,A、B、C共同含有的元素在周期表中的位置第三周期第IIIA族;
(2)指出H中化学键类型离子键和共价键,写出与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的电子式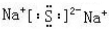 .
.
(3)常温下C溶液的PH<7,(填“<”、“>”或“=”)写出C溶液中通入少量盐酸生成B的化学方程式HCl+NaAlO2+H2O=Al(OH)3↓+NaCl.写出C溶液中滴加NaHCO3溶液的离子方程式AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-.
(4)Zn和Cu分别和一定量F的浓溶液反应,若产生的气体体积相等(相同条件下),则下列判断正确的是BD
A.产生的气体种类一定相同 B.转移的电子一定相同
C.消耗F的物质的量一定相同 D.消耗两种金属物质的量一定相同
(5)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定浓度的苛性钾溶液中,两者恰好完全反应,生成三种含Y元素的离子,其中YO3-、YO-两种离子物质的量之比为1:2,该反应的离子方程式是10OH-+5Cl2=2ClO-+ClO3-+7Cl-+5 H2O.
 A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:
A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:| 编号 | 信息 | 编号 | 信息 |
| 1 | D为地壳中含量最高的元素组成的单质 | 4 | H为淡黄色固体化合物 |
| 2 | E为酸性气态氧化物 | 5 | 电解饱和J溶液是工业重要反应 |
| 3 | F的浓溶液常做干燥剂 | 6 | C为离子化合物,阴、阳离子均含金属元素 |
(1)A、E、H中原子序数最大的元素的元素符号S,A、B、C共同含有的元素在周期表中的位置第三周期第IIIA族;
(2)指出H中化学键类型离子键和共价键,写出与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的电子式
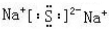 .
.(3)常温下C溶液的PH<7,(填“<”、“>”或“=”)写出C溶液中通入少量盐酸生成B的化学方程式HCl+NaAlO2+H2O=Al(OH)3↓+NaCl.写出C溶液中滴加NaHCO3溶液的离子方程式AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-.
(4)Zn和Cu分别和一定量F的浓溶液反应,若产生的气体体积相等(相同条件下),则下列判断正确的是BD
A.产生的气体种类一定相同 B.转移的电子一定相同
C.消耗F的物质的量一定相同 D.消耗两种金属物质的量一定相同
(5)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定浓度的苛性钾溶液中,两者恰好完全反应,生成三种含Y元素的离子,其中YO3-、YO-两种离子物质的量之比为1:2,该反应的离子方程式是10OH-+5Cl2=2ClO-+ClO3-+7Cl-+5 H2O.
2.R为1~18号元素,其原子所具有的电子层数为最外层电子数的$\frac{1}{2}$,它可能形成的含氧酸根离子有:①RO32-,②RO42-,③R2O32-,下列叙述判断正确的是( )
| A. | 当它可以形成①时,不可能形成③ | B. | 当它形成①时,也可以形成②和③ | ||
| C. | 当它可以形成②时,不可能形成③ | D. | 当它可以形成①时,不可能形成② |
19.据报道,挪威和荷兰正在开发一种新能源--盐能.当海水和淡水混合时,温度将升高0.1℃,世界所有入海口的这种能源相当于电力需求的20%,海水和淡水混合时,温度升高最可能的原因是( )
| A. | 由于浓度差产生放热 | B. | 发生了水分解反应 | ||
| C. | 发生了盐分解反应 | D. | 盐的溶解程度增大 |
20.常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中c(OH-):c(H+)=1012,将这两种溶液等体积混合,以下离子浓度关系判断正确的是( )
| A. | c(H+)<c(OH-)<c(B+)<c(A-) | B. | c(H+)<c(OH-)<c(A-)<c(B+) | ||
| C. | c(OH-)<c(H+)<c(B+)<c(A-) | D. | c(A-)=c(B+)>c(H+)=c(OH-) |

 的名称为3,3,4-三甲基己烷.
的名称为3,3,4-三甲基己烷.