题目内容
13.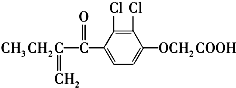 利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:
利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:下列叙述正确的是( )
| A. | 利尿酸分子内处于同一平面的原子数不超过10个 | |
| B. | 利尿酸的衍生物利尿酸甲酯的分子式是C14H14Cl2O4 | |
| C. | 该有机物有4种官能团 | |
| D. | 利尿酸能与FeCl3溶液发生显色反应 |
分析 有机物含有羧基、具有酸性,可发生中和、酯化反应,含有碳碳双键,可发生加成、加聚和氧化反应,含有氯原子,可发生取代反应,以此解该题.
解答 解:A.苯环、C=C、C=O为平面结构,与苯环直接相连的原子一定在同一平面内,所以利尿酸分子内处于同一平面的原子为17个,故A错误;
B.由结构简式可确定分子式为C13H12Cl2O4,与甲醇反应生成的酯为C14H14Cl2O4,故B正确;
C.该分子中含有碳碳双键、羰基、氯原子、醚键、羧基五种官能团,故C错误;
D.不含酚羟基,与氯化铁溶液不反应,故D错误;
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,知道常见官能团及其性质关系,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料—光导纤维,C与烧碱反应生成含A元素的化合物D
(1)B元素的原子最外层电子数与A相同,则B在元素周期中的位置___ __.
(2)写出易与C发生反应的酸与C反应的化学方程式是______________.
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E:将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F.
①写出生成D的化学反应方程式:______________.
②要将纯碱高温熔化,下列坩埚中不可选用的是__________.
A.普通玻璃坩埚 | B.石英玻璃坩埚 | C.铁坩埚 | D.瓷坩埚. |
③将过量的E通入D的溶液中发生反应的离子方程式是:_________________。
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是____________。
①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新的能源.
| A. | ②③ | B. | ②③④⑤ | C. | ①③⑤ | D. | ①③④⑤ |
 ,这种炔烃的名称为( )
,这种炔烃的名称为( )| A. | 5-甲基-3-乙基-1-己炔 | B. | 5-甲基-3-乙基-2-己炔 | ||
| C. | 4-甲基-5-乙基-2-己炔 | D. | 2-甲基-4-乙基-5-己炔 |
| A. | 有化学键破坏的变化一定属于化学变化 | |
| B. | 发生了颜色变化的一定是化学变化 | |
| C. | 有气泡产生或沉淀析出的变化一定是化学变化 | |
| D. | 燃烧一定是化学变化 |
 A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:
A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:| 编号 | 信息 | 编号 | 信息 |
| 1 | D为地壳中含量最高的元素组成的单质 | 4 | H为淡黄色固体化合物 |
| 2 | E为酸性气态氧化物 | 5 | 电解饱和J溶液是工业重要反应 |
| 3 | F的浓溶液常做干燥剂 | 6 | C为离子化合物,阴、阳离子均含金属元素 |
(1)A、E、H中原子序数最大的元素的元素符号S,A、B、C共同含有的元素在周期表中的位置第三周期第IIIA族;
(2)指出H中化学键类型离子键和共价键,写出与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的电子式
 .
.(3)常温下C溶液的PH<7,(填“<”、“>”或“=”)写出C溶液中通入少量盐酸生成B的化学方程式HCl+NaAlO2+H2O=Al(OH)3↓+NaCl.写出C溶液中滴加NaHCO3溶液的离子方程式AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-.
(4)Zn和Cu分别和一定量F的浓溶液反应,若产生的气体体积相等(相同条件下),则下列判断正确的是BD
A.产生的气体种类一定相同 B.转移的电子一定相同
C.消耗F的物质的量一定相同 D.消耗两种金属物质的量一定相同
(5)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定浓度的苛性钾溶液中,两者恰好完全反应,生成三种含Y元素的离子,其中YO3-、YO-两种离子物质的量之比为1:2,该反应的离子方程式是10OH-+5Cl2=2ClO-+ClO3-+7Cl-+5 H2O.
| A. | 当它可以形成①时,不可能形成③ | B. | 当它形成①时,也可以形成②和③ | ||
| C. | 当它可以形成②时,不可能形成③ | D. | 当它可以形成①时,不可能形成② |