题目内容
14. 铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.
铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.(1)能用来制作红色涂料的铁的氧化物是Fe2O3(填化学式).
(2)向一定浓度的FeCl2溶液中滴加一定体积的30%的双氧水,可以观察到溶液变为红褐色,且能发生丁达尔效应,用pH计测得溶液pH变小.写出FeCl2与H2O2反应的离子方程式:2Fe2++H2O2+4H2O=2Fe(OH)3(胶体)+4H+.
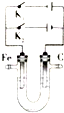
(3)如图为一电化学装置,电极分别为铁棒和碳棒.U形管中盛有饱和电解质溶液.
①若U形管中盛食盐水饱和溶液,打开K2,闭合K1,铁棒为阴极,铁棒腐蚀速率变慢(填“变快”“变慢”或“不变”),碳棒上的电极反应式为2Cl-+2e-=C12↑.
②若U形管中盛有NaOH浓溶液,打开K1,闭合K2.可以制备新型净水剂高铁酸盐(FeO42-).阳极电极反应式为Fe-6e-+8OH-=FeO42-+4H2O,阴极区溶液的pH增大 (填”增大”‘减小”或“不变”).
分析 (1)能用来制作红色涂料的铁的是氧化铁;
(2)向一定浓度的FeCl2溶液中滴加一定体积的30%的双氧水,可以观察到溶液变为红褐色,且能发生丁达尔效应,说明生成氢氧化铁胶体,用pH计测得溶液pH变小.说明产生氢离子;
(3)①若U形管中盛食盐水饱和溶液,打开K2,闭合K1,铁棒与电源的负极相连,为阴极,铁棒腐蚀速率变慢,碳棒与电源的正极相连,为电解池的阳极,氯离子放电,电极反应式为2Cl-+2e-=C12↑;
②若U形管中盛有NaOH浓溶液,打开K1,闭合K2,铁为阳极发生氧化反应,可以制备新型净水剂高铁酸盐(FeO42-),电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,而阴极是水中的氢离子放电,生成氢气,同时产生氢氧根离子.
解答 解:(1)能用来制作红色涂料的铁的是氧化铁,化学式为:Fe2O3,故答案为:Fe2O3;
(2)向一定浓度的FeCl2溶液中滴加一定体积的30%的双氧水,可以观察到溶液变为红褐色,且能发生丁达尔效应,说明生成氢氧化铁胶体,所以反应方程式为:2Fe2++H2O2+4H2O=2Fe(OH)3(胶体)+4H+,故答案为:2Fe2++H2O2+4H2O=2Fe(OH)3(胶体)+4H+;
(3)①若U形管中盛食盐水饱和溶液,打开K2,闭合K1,铁棒与电源的负极相连,为阴极,铁棒腐蚀速率变慢,碳棒与电源的正极相连,为电解池的阳极,氯离子放电,电极反应式为2Cl-+2e-=C12↑,故答案为:阴;变慢;2Cl-+2e-=C12↑;
②若U形管中盛有NaOH浓溶液,打开K1,闭合K2,铁为阳极发生氧化反应,可以制备新型净水剂高铁酸盐(FeO42-),电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,而阴极是水中的氢离子放电,生成氢气,同时产生氢氧根离子,所以阴极区溶液的pH增大,故答案为::Fe-6e-+8OH-=FeO42-+4H2O; 增大.
点评 本题考查了原电池和电解池原理,明确正负极的判断及离子放电顺序是解本题关键,难点是电极反应式的书写,题目难度中等.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料—光导纤维,C与烧碱反应生成含A元素的化合物D
(1)B元素的原子最外层电子数与A相同,则B在元素周期中的位置___ __.
(2)写出易与C发生反应的酸与C反应的化学方程式是______________.
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E:将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F.
①写出生成D的化学反应方程式:______________.
②要将纯碱高温熔化,下列坩埚中不可选用的是__________.
A.普通玻璃坩埚 | B.石英玻璃坩埚 | C.铁坩埚 | D.瓷坩埚. |
③将过量的E通入D的溶液中发生反应的离子方程式是:_________________。
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是____________。
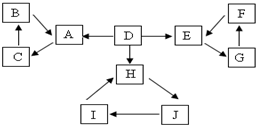 A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:
A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:| 编号 | 信息 | 编号 | 信息 |
| 1 | D为地壳中含量最高的元素组成的单质 | 4 | H为淡黄色固体化合物 |
| 2 | E为酸性气态氧化物 | 5 | 电解饱和J溶液是工业重要反应 |
| 3 | F的浓溶液常做干燥剂 | 6 | C为离子化合物,阴、阳离子均含金属元素 |
(1)A、E、H中原子序数最大的元素的元素符号S,A、B、C共同含有的元素在周期表中的位置第三周期第IIIA族;
(2)指出H中化学键类型离子键和共价键,写出与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的电子式
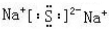 .
.(3)常温下C溶液的PH<7,(填“<”、“>”或“=”)写出C溶液中通入少量盐酸生成B的化学方程式HCl+NaAlO2+H2O=Al(OH)3↓+NaCl.写出C溶液中滴加NaHCO3溶液的离子方程式AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-.
(4)Zn和Cu分别和一定量F的浓溶液反应,若产生的气体体积相等(相同条件下),则下列判断正确的是BD
A.产生的气体种类一定相同 B.转移的电子一定相同
C.消耗F的物质的量一定相同 D.消耗两种金属物质的量一定相同
(5)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定浓度的苛性钾溶液中,两者恰好完全反应,生成三种含Y元素的离子,其中YO3-、YO-两种离子物质的量之比为1:2,该反应的离子方程式是10OH-+5Cl2=2ClO-+ClO3-+7Cl-+5 H2O.
| A. | 当它可以形成①时,不可能形成③ | B. | 当它形成①时,也可以形成②和③ | ||
| C. | 当它可以形成②时,不可能形成③ | D. | 当它可以形成①时,不可能形成② |
| A. | 由于浓度差产生放热 | B. | 发生了水分解反应 | ||
| C. | 发生了盐分解反应 | D. | 盐的溶解程度增大 |
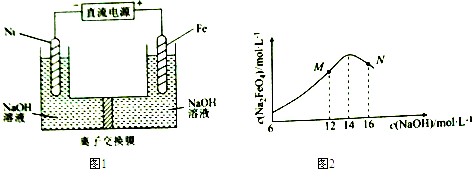
已知:FeO42-为紫红色;Na2FeO4只在强碱性条件下稳定,易被H2还原;溶液中OH-浓度过高,铁电极区会产生红褐色物质.下列说法错误的是( )
| A. | 制备Na2FeO4的电极反应为Fe-6e-+8OH-=FeO42-+4H2O | |
| B. | 电解过程中,须将阴极产生的气体及时排出 | |
| C. | MN两点中c(Na2FeO4)低于最高值的原因不同,在M点会有Fe(OH)3生成 | |
| D. | 图1中的离子交换膜为阴离子交换膜,电解过程中,阴极区附近pH会增大 |
| A. | 与水反应中既是氧化剂又是还原剂 | B. | 与NaOH反应生成溴化钠和次碘酸钠 | ||
| C. | 可作氧化剂 | D. | 与水反应是氧化还原反应 |
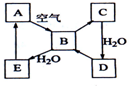 下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.