题目内容
实验室可用下列实验装置测定FeO和Fe2O3固体混合物中Fe2O3的质量(图中夹持装置已略去).
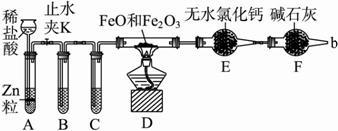
(1)实验前如何检查装置A的气密性 ;对A中所发生的反应,有时要向其中加入少量硫酸铜溶液,目的是 .
(2)为了安全,在点燃酒精灯之前,在F装置出口b处必须,实验开始后,在b处必须 .
(3)装置C中所放试剂为浓硫酸,则装置B的作用是 .
(4)干燥管E右边又连接干燥管F的目的是 .若无干燥管F,测得Fe2O3的质量将 (填“偏大““偏小“或“无影响“).
(5)若FeO和Fe2O3混合物的质量为a g,反应完全后干燥管E的质量增加了b g,则混合物中Fe2O3的质量为 g(用含字母的数学式表示).

(1)实验前如何检查装置A的气密性
(2)为了安全,在点燃酒精灯之前,在F装置出口b处必须,实验开始后,在b处必须
(3)装置C中所放试剂为浓硫酸,则装置B的作用是
(4)干燥管E右边又连接干燥管F的目的是
(5)若FeO和Fe2O3混合物的质量为a g,反应完全后干燥管E的质量增加了b g,则混合物中Fe2O3的质量为
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)对A气密性的检查用液封法;在Zn+HCl(稀)中加少量CuSO4溶液,目的是形成原电池可加快反应速率;
(2)因为H2+O2混合点燃会爆炸,即可燃性气体点燃前都必须检验纯度,实验开始后若未反应,H2排入空气也会带来危险,必须处理掉;
(3)A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验;
(4)干燥管F的作用防空气中水蒸气对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,即氧的含量增大,则FeO与Fe2O3相比较得Fe2O3的质量将偏大.
(5)设FeO、Fe2O3物质的量分别为x、y,则
,解得y=
mol,则Fe2O3的质量为:
mol×160 g?mol-1=
g.
(2)因为H2+O2混合点燃会爆炸,即可燃性气体点燃前都必须检验纯度,实验开始后若未反应,H2排入空气也会带来危险,必须处理掉;
(3)A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验;
(4)干燥管F的作用防空气中水蒸气对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,即氧的含量增大,则FeO与Fe2O3相比较得Fe2O3的质量将偏大.
(5)设FeO、Fe2O3物质的量分别为x、y,则
|
| 4b-a |
| 56 |
| 4b-a |
| 56 |
| 80b-20a |
| 7 |
解答:
解:(1)对A气密性的检查用液封法,即关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,若液面高度差不发生变化,则气密性良好;在Zn+HCl(稀)中加少量CuSO4溶液,目的是形成原电池可加快反应速率;
故答案为:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,若液面高度差不发生变化,则气密性良好;形成原电池可加快反应速率;
(2)H2+O2混合点燃会爆炸,即可燃性气体点燃前都必须检验纯度,实验开始后若未反应,H2排入空气也会带来危险,必须处理掉;故答案为:检验氢气的纯度点燃未反应的氢气;
(3)A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验,所以装置B的作用是除去氢气中混有的氯化氢气体;故答案为:除去氢气中混有的氯化氢气体;
(4)干燥管F的作用防空气中水蒸气对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,即氧的含量增大,则FeO与Fe2O3相比较得Fe2O3的质量将偏大;故答案为:防止空气中的水蒸气进入干燥管E中;偏大;
(5)设FeO、Fe2O3物质的量分别为x、y,则
,解得y=
mol,则Fe2O3的质量为:
mol×160 g?mol-1=
g,故答案为:
.
故答案为:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,若液面高度差不发生变化,则气密性良好;形成原电池可加快反应速率;
(2)H2+O2混合点燃会爆炸,即可燃性气体点燃前都必须检验纯度,实验开始后若未反应,H2排入空气也会带来危险,必须处理掉;故答案为:检验氢气的纯度点燃未反应的氢气;
(3)A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验,所以装置B的作用是除去氢气中混有的氯化氢气体;故答案为:除去氢气中混有的氯化氢气体;
(4)干燥管F的作用防空气中水蒸气对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,即氧的含量增大,则FeO与Fe2O3相比较得Fe2O3的质量将偏大;故答案为:防止空气中的水蒸气进入干燥管E中;偏大;
(5)设FeO、Fe2O3物质的量分别为x、y,则
|
| 4b-a |
| 56 |
| 4b-a |
| 56 |
| 80b-20a |
| 7 |
| 80b-20a |
| 7 |
点评:本题考查了物质性质探究实验的分析判断,装置基本操作的应用,主要是物质性质和实验过程的分析,题目难度中等.

练习册系列答案
相关题目
下列溶液中的氯离子数目与50mL 1mol/L的AlCl3溶液中氯离子数目相等的是( )
| A、150 mL 1 mol/L的NaCl溶液 |
| B、75 mL 1 mol/L的NH4Cl溶液 |
| C、150 mL 3 mol/L的KCl溶液 |
| D、75 mL 2 mol/L的CaCl2溶液 |
下列说法正确的是( )
①元素原子的最外层电子数等于元素的最高化合价
②最外层一个电子的元素一定是金属元素,肯定在元素周期表的第IA族
③所有元素的原子最外层最多可容纳的电子数均为8
④第3周期元素随原子序数增大各非金属元素对应的氧化物的水化物酸性一定逐渐增强
⑤同主族元素随原子序数增大,其原子半径逐渐增大.
①元素原子的最外层电子数等于元素的最高化合价
②最外层一个电子的元素一定是金属元素,肯定在元素周期表的第IA族
③所有元素的原子最外层最多可容纳的电子数均为8
④第3周期元素随原子序数增大各非金属元素对应的氧化物的水化物酸性一定逐渐增强
⑤同主族元素随原子序数增大,其原子半径逐渐增大.
| A、①②③④⑤ | B、①②③ |
| C、④⑤ | D、⑤ |

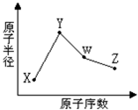 X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.