题目内容
下列说法正确的是( )
①元素原子的最外层电子数等于元素的最高化合价
②最外层一个电子的元素一定是金属元素,肯定在元素周期表的第IA族
③所有元素的原子最外层最多可容纳的电子数均为8
④第3周期元素随原子序数增大各非金属元素对应的氧化物的水化物酸性一定逐渐增强
⑤同主族元素随原子序数增大,其原子半径逐渐增大.
①元素原子的最外层电子数等于元素的最高化合价
②最外层一个电子的元素一定是金属元素,肯定在元素周期表的第IA族
③所有元素的原子最外层最多可容纳的电子数均为8
④第3周期元素随原子序数增大各非金属元素对应的氧化物的水化物酸性一定逐渐增强
⑤同主族元素随原子序数增大,其原子半径逐渐增大.
| A、①②③④⑤ | B、①②③ |
| C、④⑤ | D、⑤ |
考点:元素周期律和元素周期表的综合应用,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:①F元素原子的最外层有7个电子,而F没有最高正化合价;
②氢元素原子最外层是一个电子,它是非金属元素;
③第一周期的元素的原子最外层最多可容纳2个电子;
④第3周期元素随原子序数增大各非金属元素对应的最高价的氧化物的水化物酸性一定逐渐增强;
⑤同主族元素电子层数越多,原子半径越大,所以随原子序数增大,其原子半径逐渐增大.
②氢元素原子最外层是一个电子,它是非金属元素;
③第一周期的元素的原子最外层最多可容纳2个电子;
④第3周期元素随原子序数增大各非金属元素对应的最高价的氧化物的水化物酸性一定逐渐增强;
⑤同主族元素电子层数越多,原子半径越大,所以随原子序数增大,其原子半径逐渐增大.
解答:
解:①F元素原子的最外层有7个电子,而F没有最高正化合价,故错误;
②氢元素原子最外层是一个电子,它是非金属元素,故错误;
③第一周期的元素的原子最外层最多可容纳2个电子,故错误;
④第3周期元素随原子序数增大各非金属元素对应的最高价的氧化物的水化物酸性一定逐渐增强,故错误;
⑤同主族元素电子层数越多,原子半径越大,所以随原子序数增大,其原子半径逐渐增大,故正确;
故选D.
②氢元素原子最外层是一个电子,它是非金属元素,故错误;
③第一周期的元素的原子最外层最多可容纳2个电子,故错误;
④第3周期元素随原子序数增大各非金属元素对应的最高价的氧化物的水化物酸性一定逐渐增强,故错误;
⑤同主族元素电子层数越多,原子半径越大,所以随原子序数增大,其原子半径逐渐增大,故正确;
故选D.
点评:本题主要考查了原子结构和元素周期律,难度不大,答题时注意一些特殊情况的元素原子结构以及要仔细审题.

练习册系列答案
 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
30℃时,在某硫酸铜溶液中加入27.5g CuSO4或加入50.0g CuSO4?5H2O,恢复到30℃时,都刚好成为饱和溶液,则30℃时CuSO4的溶解度是( )
| A、4.5 g |
| B、22.5 g |
| C、25 g |
| D、32 g |
下列反应的离子方程式表示正确的是( )
| A、向Fe(NO3)3溶液中加入过量的HI溶液:2NO3+8H++6I═3I2+2NO↑+4H2O |
| B、硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| C、FeCl3溶液中通入过量的H2S气体:2Fe3++H2S═S↓+2Fe2++2H+ |
| D、NaHCO3溶液与过量Ba(OH)2溶液反应:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O |
在宁波奉化境内有一个“长寿村”,许多大都市的老年人到那里观光,还有人在那买房子.经科学研究表明是因为饮用水中有“硒”等矿物质,可以改善人体营养,增强体质.其中的“硒”是指( )
| A、分子 | B、原子 | C、离子 | D、元素 |
随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一.反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570K时平衡常数为1×1059.下列说法正确的是( )
| A、提高尾气净化效率的最佳途径是研制高效催化剂 |
| B、提高尾气净化效率的常用方法是升高温度 |
| C、装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| D、570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳 |
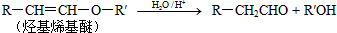

 .
.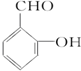 的属于芳香族化合物的两种官能团异构体的结构简式:
的属于芳香族化合物的两种官能团异构体的结构简式: )的一条路线如下
)的一条路线如下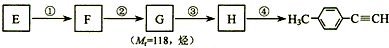
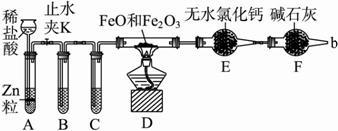
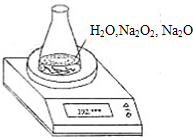 测某种含有少量氧化钠的过氧化钠试样的质量分数.
测某种含有少量氧化钠的过氧化钠试样的质量分数.