题目内容
用单线桥表示下列反应
(1)2KClO3═2KCl+3O2↑
(2)Zn+H2SO4═ZnSO4+H2↑
(1)2KClO3═2KCl+3O2↑
(2)Zn+H2SO4═ZnSO4+H2↑
考点:氧化还原反应的电子转移数目计算
专题:
分析:(1)反应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O2中0价,转移电子数为12;
(2)反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素化合价升高,被氧化,为还原剂,H元素化合价降低,被还原,H2SO4为氧化剂,转移2e-.
(2)反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素化合价升高,被氧化,为还原剂,H元素化合价降低,被还原,H2SO4为氧化剂,转移2e-.
解答:
解:(1)应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O2中0价,转移电子数为12,用单线桥表示电子转移的情况为: ,答:单线桥表示电子转移的情况为
,答:单线桥表示电子转移的情况为 ;
;
(2)Zn+H2SO4(稀)=ZnSO4+H2↑中,Zn元素的化合价升高,H元素非化合价降低,转移的电子数为2e-,电子转移的方向和数目为 ,答:单线桥表示电子转移的情况为
,答:单线桥表示电子转移的情况为 .
.
 ,答:单线桥表示电子转移的情况为
,答:单线桥表示电子转移的情况为 ;
;(2)Zn+H2SO4(稀)=ZnSO4+H2↑中,Zn元素的化合价升高,H元素非化合价降低,转移的电子数为2e-,电子转移的方向和数目为
 ,答:单线桥表示电子转移的情况为
,答:单线桥表示电子转移的情况为 .
.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应电子转移方向和数目的考查,题目难度不大.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
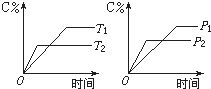 可逆反应mA(s)+nB(g)?pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是( )
可逆反应mA(s)+nB(g)?pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是( )| A、到达平衡后,若使用催化剂,C的质量分数增大 |
| B、平衡后,若升高温度,平衡则向逆反应方向移动 |
| C、平衡后,增大A的量,有利于平衡向正反应方向移动 |
| D、化学方程式中一定n>p+q |
下列反应的离子方程式正确的是( )
| A、石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ |
| B、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、硫酸铜与烧碱溶液反应:CuSO4+2OH-═Cu(OH)2↓+SO42- |
| D、氢氧化铝中和胃酸(盐酸):Al(OH)3+3H+═Al3++3H2O |
30℃时,在某硫酸铜溶液中加入27.5g CuSO4或加入50.0g CuSO4?5H2O,恢复到30℃时,都刚好成为饱和溶液,则30℃时CuSO4的溶解度是( )
| A、4.5 g |
| B、22.5 g |
| C、25 g |
| D、32 g |
下列各反应中电子转移情况表示正确的是( )
A、 |
B、 |
C、 |
D、 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、物质的量浓度为0.5mol/L Mg Cl2溶液,含有Cl-离子数为NA |
| B、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| C、22.4L氖气所含有的原子数目为NA |
| D、常温常压下,14g N2含有分子数为NA |
下列反应的离子方程式表示正确的是( )
| A、向Fe(NO3)3溶液中加入过量的HI溶液:2NO3+8H++6I═3I2+2NO↑+4H2O |
| B、硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| C、FeCl3溶液中通入过量的H2S气体:2Fe3++H2S═S↓+2Fe2++2H+ |
| D、NaHCO3溶液与过量Ba(OH)2溶液反应:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O |