题目内容
19. 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:①氯气与冷的氢氧化钠溶液反应生成NaClO;氯气与热的氢氧化钠溶液反应可生成NaClO和NaClO3.②在酸性较弱时KI只能被NaClO氧化,在酸性较强时亦能被NaClO3氧化.
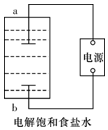
(1)该小组利用如图所示装置制取家用消毒液(主要成分为NaClO),则a为阴极(填“阳极”或“阴极”).生成NaClO的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O.
(2)该小组将0.784L(标准状况)Cl2通入50.00mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0mL.
Ⅰ.取稀释后的溶液25.00mL用醋酸酸化,加入过量KI溶液.用0.2000mol•L-1 Na2S2O3溶液滴定:I2+2S2O32-═2I-+S4O62-,消耗Na2S2O3溶液10.00mL 时恰好到达终点.
Ⅱ.将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00mL.
①操作Ⅱ中氯酸钠与碘化钾反应的离子方程式为ClO3-+6I-+6H+═3I2+Cl-+3H2O.
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为1:1.
分析 (1)电解饱和食盐水,生成了氢气和氯气;a得到了氢气,溶液中产生了氢氧根,发生了还原反应,故A为阴极,生成NaClO的离子方程式是:Cl2+2OH-═Cl-+ClO-+H2O;
(2)①在酸性较强I-能被NaClO3氧化成碘单质,反应方程式是:ClO3-+6I-+6H+═3I2+Cl-+3H2O;
②根据反应方程找出关系式ClO-~2I-~I2~2S2O32-、ClO3-~6I-~3I2 ~6S2O32-,然后计算出次氯酸钠和氯酸钠的物质的量.
解答 解:(1)a极生成了氢氧根,溶液中水电离的氢离子得到电子被还原,a为阴极,反应生成NaClO的离子方程式是:Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:阴极;Cl2+2OH-═Cl-+ClO-+H2O;
(2)①酸性较强条件下,ClO3-将I-氧化成I2,根据化合价升降相等配平,反应的化学方程式是:ClO3-+6I-+6H+═3I2+Cl-+3H2O;
故答案为:ClO3-+6I-+6H+═3I2+Cl-+3H2O;
②用醋酸酸化,只有次氯酸钠氧化碘化钾,消耗Na2S2O3溶液10.00mL,由关系式ClO-~2I-~I2~2S2O32-
n(NaClO)=n(I2)=0.5×n(S2O32-)=0.5×0.2000mol/L×0.010L=0.001mol;
用盐酸酸化至强酸性,氯酸钾氧化碘化钠,消耗Na2S2O3溶液30.00mL;根据关系式:ClO3-~6I-~3I2 ~6S2O32-,
n(NaClO3)=$\frac{1}{3}$×n(I2)=$\frac{1}{6}$×n(S2O32-)=$\frac{1}{6}$×0.2000mol/L×0.03L=0.001mol;
故n(NaClO):n(NaClO3)=1:1;
故答案为:1:1.
点评 本题考查了电极反应、次氯酸钠、氯酸钠的性质,涉及了较多的计算,成分考查了化学计算能力,可以找出关系式进行求解,本题难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | NaOH溶液 | B. | 浓氨水 | C. | NaCl溶液 | D. | Na2SO4溶液 |
| A. | 2H2O+O2+4e-=4OH- | B. | Fe-2e-=Fe2+ | ||
| C. | 2H++2e-=H2↑ | D. | Fe-3e-=Fe3+ |
| A. | 钠和水反应:2Na+2H2O=2Na++2OH-+H2↑ | |
| B. | 盐酸与氢氧化钡溶液反应:H++OH-=H2O | |
| C. | 三氯化铁腐蚀印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| D. | 金属铝与氢氧化钠溶液反应:2Al+2OH-=2AlO2-+H2↑ |
| A. | 烧碱、纯碱、熟石灰都是碱 | B. | 铝土矿、水玻璃、小苏打都是混合物 | ||
| C. | Na2O、Al2O3、Fe2O3都是碱性氧化物 | D. | H2SO4、KOH、NaCl都是电解质 |
 的名称2-硝基甲苯(邻硝基甲苯).
的名称2-硝基甲苯(邻硝基甲苯).