题目内容
7.要将溶液中的Al3+沉淀完全,则下列试剂中的最佳试剂是( )| A. | NaOH溶液 | B. | 浓氨水 | C. | NaCl溶液 | D. | Na2SO4溶液 |
分析 Al3+可以和碱反应,也可以和能水解显碱性的盐反应;Al(OH)3是两性氢氧化物能溶于强酸强碱,Al3+离子全部沉淀需要所加的试剂过量,所以全部沉淀Al3+最好不用强碱用弱碱,以此解答该题.
解答 解:A.氢氧化钠是强碱,能使部分氢氧化铝转化为偏铝酸钠,所以不能使铝离子完全转化为沉淀,故A错误;
B.氨水属于弱碱,氢氧化铝不溶于弱碱,所以可以将铝离子完全沉淀下来,故B正确;
C.氯化钠和铝离子不反应,故C错误;
D.硫酸钠和铝离子不反应,所以得不到沉淀,故D错误.
故选B.
点评 本题考查了氢氧化铝的制取,为高频考点,侧重考查学生的分析能力,明确氢氧化铝的性质是解本题关键,氢氧化铝是中学阶段学习的唯一一个氢氧化物,能溶于强碱但不溶于弱碱,所以实验室用可溶性铝盐和氨水制取氢氧化铝沉淀.

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
8.在盐类的水解过程中,下列各种情况必定发生的是( )
| A. | 盐的电离平衡被破坏 | B. | 溶液温度升高 | ||
| C. | 25℃,溶液的pH不是7 | D. | 水的电离平衡被破坏 |
15.将0.4mol•L-1NaHS溶液与0.2mol•L-1KOH溶液等体积混合,下列关系正确的是(已知HS-的水解程度大于电离程度)( )
| A. | c(Na+)>c(HS-)>c(K+)>c(S2-)>c(OH-)>c(H-) | B. | c(H+)>c(OH-) | ||
| C. | 2c(K+)+c(H+)═c(HS-)+2c(S2-) | D. | c(OH-)+c(S2-)=c(H+)+c(HS-)+2c(H2S) |
2.氯化亚铜晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化.氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如图.
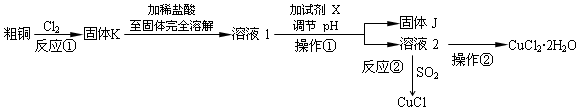
按要求回答下列问题:
(1)CuCl中Cu元素的化合价为+1价.操作②为加少量盐酸,蒸发浓缩、冷却结晶,过滤,洗涤,干燥
(2)溶液1可加试剂X用于调节pH,以除去杂质,试剂 X和固体J分别是c(填序号).
a.NaOH Fe(OH) b.NH3•H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-.
(4)实验室保存新制CuCl晶体的方法是避光、密封保存.
(5)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.100mol•L-1硫酸铈标准溶液滴定.
已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+.
三次平行实验结果如表(平行实验结果相差不能超过1%):
则样品中CuCl的纯度为95.5%(结果保留三位有效数字).
(6)如图所示将氯气从a通入与粗铜反应(铁架台、铁夹、酒精灯省略),
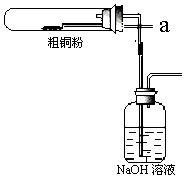
①反应时,盛粗铜粉的试管中的现象是产生大量棕黄色烟.
②反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效.该电化学腐蚀过程中的正极反应式为ClO-+2e-+H2O=Cl-+2OH-.

按要求回答下列问题:
(1)CuCl中Cu元素的化合价为+1价.操作②为加少量盐酸,蒸发浓缩、冷却结晶,过滤,洗涤,干燥
(2)溶液1可加试剂X用于调节pH,以除去杂质,试剂 X和固体J分别是c(填序号).
a.NaOH Fe(OH) b.NH3•H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-.
(4)实验室保存新制CuCl晶体的方法是避光、密封保存.
(5)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.100mol•L-1硫酸铈标准溶液滴定.
已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+.
三次平行实验结果如表(平行实验结果相差不能超过1%):
| 平行次数 | 1 | 2 | 3 |
| 0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
(6)如图所示将氯气从a通入与粗铜反应(铁架台、铁夹、酒精灯省略),

①反应时,盛粗铜粉的试管中的现象是产生大量棕黄色烟.
②反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效.该电化学腐蚀过程中的正极反应式为ClO-+2e-+H2O=Cl-+2OH-.
12.下列物质中属于天然高分子化合物的是( )
| A. | 乙酸 | B. | 葡萄糖 | C. | 淀粉 | D. | 维生素 |

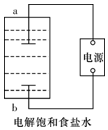 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载: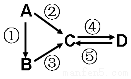 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系: