题目内容
如图是某条件时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )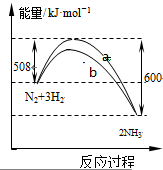

| A、加入催化剂可增大正反应速率,降低逆反应速率 |
| B、正反应的活化能大于逆反应的活化能 |
| C、b曲线是未加入催化剂时的能量变化曲线 |
| D、该反应的热化学方程式为:2NH3?N2+3H2△H=-92 kJ?mol-1 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:由图象可知,反应物总能量大于生成物总能量,正反应为放热反应,加入催化剂,降低活化能,b应为加入催化剂,1mol氮气和3mol氢气,反应热为△H=-92 kJ?mol-1,以此解答该题.
解答:
解:A.催化剂可同等程度增大正逆反应速率,故A错误;
B.正反应为放热反应,正反应的活化能小于逆反应的活化能,故B错误;
C.加入催化剂,降低活化能,b应为加入催化剂,故C正确;
D.1mol氮气和3mol氢气,反应热为△H=-92 kJ?mol-1,则该反应的热化学方程式为:2NH3?N2+3H2△H=-184 kJ?mol-1,故D错误.
故选C.
B.正反应为放热反应,正反应的活化能小于逆反应的活化能,故B错误;
C.加入催化剂,降低活化能,b应为加入催化剂,故C正确;
D.1mol氮气和3mol氢气,反应热为△H=-92 kJ?mol-1,则该反应的热化学方程式为:2NH3?N2+3H2△H=-184 kJ?mol-1,故D错误.
故选C.
点评:本题考查化学反应与能量变化,为高频考点,侧重于热化学方程式书写,图象分析判断,反应能量变化,催化剂作用分析,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强,或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,则对该反应叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强,或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,则对该反应叙述正确的是( )| A、正反应是放热反应,m+n>p+q |
| B、逆反应是放热反应,m+n>p+q |
| C、正反应是放热反应,m+n<p+q |
| D、逆反应是放热反应,m+n<p+q |
下列说法正确的是( )
| A、化学键的断裂和形成是化学反应的实质,化学反应前后能量不变 |
| B、凡是放热反应都是自发的,吸热反应都是非自发的 |
| C、若一个反应的平衡常数越大,则表示该反应速率也越大 |
| D、升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 |
xR2++yH++O2=mR3++nH2O中,对m和R3+判断正确的是( )
| A、m=4,R3+是还原产物 |
| B、m=4,R3+是氧化产物 |
| C、2m=y,R3+是还原产物 |
| D、2m=y,R3+是氧化产物 |
对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);△H<0(kJ?mol-1)的化学反应,下列叙述一定正确的是( )
A、 反应过程中能量关系可用右图表示 |
| B、1mol锌的能量高于1molH2所含的能量 |
| C、若将该反应设计成原电池,则锌为正极 |
| D、若将其设计为原电池,则当有32.5g锌溶解时,正极放出的气体体积一定为22.4L(标况) |
向100m 2mol?L-1的NaOH溶液中通入一定量的CO2气体,将溶液蒸发结晶,得到9.3g白色固体(假设不含结晶水),该白色固体的组成是( )
| A、只含Na2CO3 |
| B、只含NaHCO3 |
| C、NaOH和Na2CO3的混合物 |
| D、Na2CO3和NaHCO3的混合物 |
下列叙述不正确的是( )
| A、与28 g CO具有相同分子数的CO2的质量一定是44 g |
| B、1 mol Al3+含有的核外电子数为3NA |
| C、常温常压下,1 mol氦气含有的原子数为NA |
| D、1 L 1 mol?L-1NaOH溶液中氧原子的数目大于NA |

