题目内容
下列说法正确的是( )
| A、化学键的断裂和形成是化学反应的实质,化学反应前后能量不变 |
| B、凡是放热反应都是自发的,吸热反应都是非自发的 |
| C、若一个反应的平衡常数越大,则表示该反应速率也越大 |
| D、升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、任何化学反应前后都有能量变化;
B、反应自发与否决定于焓变和熵变两方面;
C、平衡常数可以表示反应正向进行程度,与反应速率无关;
D、升高温度,分子能量增大,活化分子数目增多.
B、反应自发与否决定于焓变和熵变两方面;
C、平衡常数可以表示反应正向进行程度,与反应速率无关;
D、升高温度,分子能量增大,活化分子数目增多.
解答:
解:A、任何化学反应的反应物和生成物所含能量都不相同,故A错误;
B、反应自发与否决定于焓变和熵变两方面,看△H-T△S的大小,故B错误;
C、平衡常数越大反应正向进行的程度越大,反应速率不一定快,故C错误;
D、升高温度,分子能量增大,活化分子数目增多,所以活化分子百分数增大,故D正确;
故选D.
B、反应自发与否决定于焓变和熵变两方面,看△H-T△S的大小,故B错误;
C、平衡常数越大反应正向进行的程度越大,反应速率不一定快,故C错误;
D、升高温度,分子能量增大,活化分子数目增多,所以活化分子百分数增大,故D正确;
故选D.
点评:本题考查了化学反应中能量变化的原因、反应自发与否的条件、化学平衡常数、活化分子的相关知识,题目难度不大.

练习册系列答案
相关题目
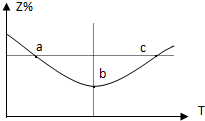 在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )
在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )| A、升高温度,平衡常数减小 |
| B、Z在a、c两点的反应速率相等 |
| C、b点时,Z的转化率最小 |
| D、平衡时充入惰性气体时,平衡向逆反应方向移动 |
Na2CO3俗名纯碱,下列对Na2CO3采用不同分类法的分类.不正确的是( )
| A、Na2CO3是碱 |
| B、Na2CO3是盐 |
| C、Na2CO3是正盐 |
| D、Na2CO3是钠盐 |
部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( )


| A、V=224 |
| B、样品中Fe的质量为2.14g |
| C、样品中CuO的质量为3.52g |
| D、未氧化前Fe元素的质量分数约为41.2% |
下列热化学方程式书写正确的是( )
A、2SO2+O2
| |||
| B、C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol | |||
C、500℃、30MPa下,将0.5mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
| |||
| D、2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2589.6kJ/moL |
如图是某条件时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )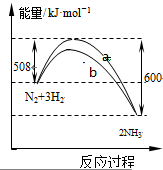

| A、加入催化剂可增大正反应速率,降低逆反应速率 |
| B、正反应的活化能大于逆反应的活化能 |
| C、b曲线是未加入催化剂时的能量变化曲线 |
| D、该反应的热化学方程式为:2NH3?N2+3H2△H=-92 kJ?mol-1 |
下列叙述中正确的是( )
| A、将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| B、用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| C、洗净的锥形瓶和滴定管可以放进烘箱中烘干 |
| D、氢氟酸试剂和NaOH溶液不可用带玻璃塞的玻璃瓶存放 |
下列各组分子中,只由极性键构成的非极性分子是( )
| A、CH4 |
| B、O3 |
| C、NH3 |
| D、Cl2 |