题目内容
向100m 2mol?L-1的NaOH溶液中通入一定量的CO2气体,将溶液蒸发结晶,得到9.3g白色固体(假设不含结晶水),该白色固体的组成是( )
| A、只含Na2CO3 |
| B、只含NaHCO3 |
| C、NaOH和Na2CO3的混合物 |
| D、Na2CO3和NaHCO3的混合物 |
考点:化学方程式的有关计算
专题:
分析:NaOH溶液中通入一定量的CO2后,结晶,得到的白色固体可能为:①只有碳酸钠,②碳酸钠和氢氧化钠的混合物、③只含有碳酸氢钠、④碳酸氢钠和碳酸钠的混合物,根据钠元素守恒进行极端讨论得出正确结论即可.
解答:
解:氢氧化钠的物质的量为:n(NaOH)=0.1L×2mol/L=0.2mol,
①若白色固体完全为碳酸钠,根据钠原子守恒,生成碳酸钠的物质的量为0.1mol,质量为10.6g>9.3g,不可能;
②若白色固体为氢氧化钠和碳酸钠的混合物,假设完全为氢氧化钠,则质量为8.0g,若完全为碳酸钠,则质量为10.6g,8.0g<9.3g<10.6g,可能为二者的混合物;
③若白色固体为碳酸氢钠和碳酸钠的混合物,完全为碳酸钠时,固体质量为10.6g,完全为碳酸氢钠时,固体质量为:16.8g,所以白色固体的最小质量为10.6g>9.3g,所以不可能碳酸钠和碳酸氢钠的混合物;
④完全为碳酸氢钠时,白色固体的质量为16.8g>9.3g,不可能;
根据以上讨论可知,反应产物为NaOH和Na2CO3的混合物,
故选C.
①若白色固体完全为碳酸钠,根据钠原子守恒,生成碳酸钠的物质的量为0.1mol,质量为10.6g>9.3g,不可能;
②若白色固体为氢氧化钠和碳酸钠的混合物,假设完全为氢氧化钠,则质量为8.0g,若完全为碳酸钠,则质量为10.6g,8.0g<9.3g<10.6g,可能为二者的混合物;
③若白色固体为碳酸氢钠和碳酸钠的混合物,完全为碳酸钠时,固体质量为10.6g,完全为碳酸氢钠时,固体质量为:16.8g,所以白色固体的最小质量为10.6g>9.3g,所以不可能碳酸钠和碳酸氢钠的混合物;
④完全为碳酸氢钠时,白色固体的质量为16.8g>9.3g,不可能;
根据以上讨论可知,反应产物为NaOH和Na2CO3的混合物,
故选C.
点评:本题考查了有关范围讨论的计算,题目难度中等,注意掌握有关范围讨论的化学计算方法,明确氢氧化钠与二氧化碳的反应原理是解答本题的关键.

练习册系列答案
相关题目
如图是某条件时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )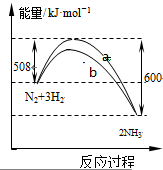

| A、加入催化剂可增大正反应速率,降低逆反应速率 |
| B、正反应的活化能大于逆反应的活化能 |
| C、b曲线是未加入催化剂时的能量变化曲线 |
| D、该反应的热化学方程式为:2NH3?N2+3H2△H=-92 kJ?mol-1 |
下列叙述中正确的是( )
| A、将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| B、用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| C、洗净的锥形瓶和滴定管可以放进烘箱中烘干 |
| D、氢氟酸试剂和NaOH溶液不可用带玻璃塞的玻璃瓶存放 |
工厂用FeCl3溶液腐蚀表面镀有铜的印刷电路板.课外活动小组为确定生产后废液的组成,进行如下实验:
(1)取10.0mL废液加入足量的AgNO3溶液,生成沉淀8.61g.
(2)另取10.0mL废液放入铜片充分反应,铜片质量减少了0.256g.
下列关于原废液组成的判断正确的是( )
(1)取10.0mL废液加入足量的AgNO3溶液,生成沉淀8.61g.
(2)另取10.0mL废液放入铜片充分反应,铜片质量减少了0.256g.
下列关于原废液组成的判断正确的是( )
| A、一定含有Fe2+、Fe3+、Cu2+、Cl- |
| B、c(Cl-)=3.0 mol?L-1 |
| C、c(Fe2+):c(Cu2+)=1:1 |
| D、c(Fe2+):c(Fe3+)=3:2 |
下列各组分子中,只由极性键构成的非极性分子是( )
| A、CH4 |
| B、O3 |
| C、NH3 |
| D、Cl2 |