题目内容
对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);△H<0(kJ?mol-1)的化学反应,下列叙述一定正确的是( )
A、 反应过程中能量关系可用右图表示 |
| B、1mol锌的能量高于1molH2所含的能量 |
| C、若将该反应设计成原电池,则锌为正极 |
| D、若将其设计为原电池,则当有32.5g锌溶解时,正极放出的气体体积一定为22.4L(标况) |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)△H<0,反应为放热反应,则反应物的总能量大于生成物的总能量,当将该反应设计呈原电池时,Zn为负极,被氧化,正极上析出氢气,以此解答该题.
解答:
解:A.反应为放热反应,则反应物的总能量大于生成物的总能量,图示正确,故A正确;
B.反应物的总能量大于生成物的总能量,Zn与氢气的能量大小无法比较,故B错误;
C.反应中Zn被氧化生成ZnSO4,当将该反应设计呈原电池时,Zn为负极,故C错误;
D.若将其设计为原电池,当有32.5g锌溶解时,转移电子1mol,则正极放出气体的体积在标况下为11.2L,故D错误.
故选A.
B.反应物的总能量大于生成物的总能量,Zn与氢气的能量大小无法比较,故B错误;
C.反应中Zn被氧化生成ZnSO4,当将该反应设计呈原电池时,Zn为负极,故C错误;
D.若将其设计为原电池,当有32.5g锌溶解时,转移电子1mol,则正极放出气体的体积在标况下为11.2L,故D错误.
故选A.
点评:本题考查化学反应能量的变化,题目难度不大,本题注意反应热以及原电池的工作原理,学习中注意相关知识的理解和掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( )


| A、V=224 |
| B、样品中Fe的质量为2.14g |
| C、样品中CuO的质量为3.52g |
| D、未氧化前Fe元素的质量分数约为41.2% |
如图是某条件时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )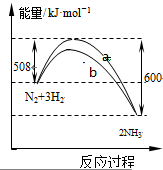

| A、加入催化剂可增大正反应速率,降低逆反应速率 |
| B、正反应的活化能大于逆反应的活化能 |
| C、b曲线是未加入催化剂时的能量变化曲线 |
| D、该反应的热化学方程式为:2NH3?N2+3H2△H=-92 kJ?mol-1 |
下列叙述正确的是( )
| A、氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
| B、含有最低价元素的化合物不一定具有很强的还原性 |
| C、阳离子只能得电子被还原,阴离子只能失电子被氧化 |
| D、在化学反应中,得电子越多的氧化剂,其氧化性就越强 |
下列叙述中正确的是( )
| A、将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| B、用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| C、洗净的锥形瓶和滴定管可以放进烘箱中烘干 |
| D、氢氟酸试剂和NaOH溶液不可用带玻璃塞的玻璃瓶存放 |
工厂用FeCl3溶液腐蚀表面镀有铜的印刷电路板.课外活动小组为确定生产后废液的组成,进行如下实验:
(1)取10.0mL废液加入足量的AgNO3溶液,生成沉淀8.61g.
(2)另取10.0mL废液放入铜片充分反应,铜片质量减少了0.256g.
下列关于原废液组成的判断正确的是( )
(1)取10.0mL废液加入足量的AgNO3溶液,生成沉淀8.61g.
(2)另取10.0mL废液放入铜片充分反应,铜片质量减少了0.256g.
下列关于原废液组成的判断正确的是( )
| A、一定含有Fe2+、Fe3+、Cu2+、Cl- |
| B、c(Cl-)=3.0 mol?L-1 |
| C、c(Fe2+):c(Cu2+)=1:1 |
| D、c(Fe2+):c(Fe3+)=3:2 |
古诗词是我国重要的文化遗产,下列诗句中加点字部分示涉及化学反应的是( )
A、
| ||||||||||||||
B、春蚕到死丝方尽,
| ||||||||||||||
C、宝剑
| ||||||||||||||
D、莫道雪融便无迹,
|