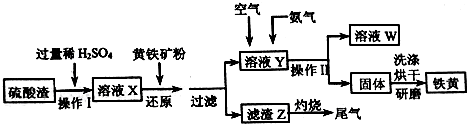
题目内容
4.电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验:(1)如图1为某实验小组依据氧化还原反应 (用离子方程式表示):Fe+Cu2+=Cu+Fe2+
设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2 mol电子.
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式2H++2e-=H2↑,
这是由于NH4Cl溶液显酸性(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因NH4++H2O?NH3•H2O+H+.
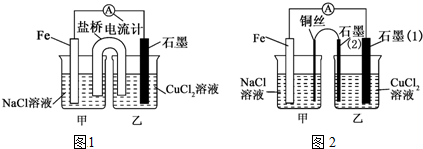
(3)如图2其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨(1)为阴极(填正、负、阴、阳),乙装置中与铜线相连石墨(2)电极上发生的反应式为2Cl--2e-=Cl2↑.
分析 (1)根据自发氧化还原反应知识来书写,并根据两极反应结合两极质量变化进行计算;
(2)氯化铵中,铵根离子水解导致溶液显示酸性,正极生成氢气;
(3)根他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池.
解答 解:(1)设计的原电池装置的自发氧化还原反应是:Fe+Cu2+=Cu+Fe2+,设电子转移量是x,则64×0.5x+56×0.5x=12,解得x=0.2,
故答案为:Fe+Cu2+=Cu+Fe2+;0.2;
(2)氯化铵中,铵根离子水解导致溶液显示酸性,实质是:NH4++H2O?NH3•H2O+H+,正极发生2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;酸性;NH4++H2O?NH3•H2O+H+;
(3)其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池,Fe是负极,Cu丝是正极,所以其中与铜线相连石墨电极是阳极,该极上发生的反应式为2Cl--2e-=Cl2↑,故答案为:阴;2Cl--2e-=Cl2↑.
点评 本题涉及原电池、电解池的工作原理以及电极反应式的书写和电子守恒的应用知识,为高频考点,侧重于学生的分析、计算能力的考查,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
14.常温下,某酸HA的电离常数:K=1×10-5,下列说法正确的是( )
| A. | HA溶液中加入NaA固体后,$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-) | |
| D. | 常温下,0.1mol/LNaA溶液水解常数为10-9 |
15. 在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )
 在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )| A. | 该化学反应在3min时达到平衡状态 | |
| B. | 保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol•L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向上述容器中充入0.5molCO2、1.5molH2,平衡时CO2的转化率小于75% | |
| D. | 12min时,向上述容器中再充入0.25molCO2、0.25molH2O(g),此时反应将向逆反应方向进行 |
12.化学工业在经济发展中的作用举足轻重,下列有关工业生产的叙述中,正确的是( )
| A. | 硫酸生产中常采用高压条件提高SO2的转化率 | |
| B. | 合成氨中采用及时分离氨气提高反应速率 | |
| C. | 电解精炼铜时,溶液中c(Cu2+)会略有减小 | |
| D. | 氯碱工业电解饱和食盐水时,阳极得到氢氧化钠和氢气 |
19.下列有关化学反应能量的叙述正确的是( )
| A. | 放热反应都不需要加热 | |
| B. | 化学反应的热效应数值与参加反应的物质多少有关 | |
| C. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| D. | 焓变是指1 mol物质参加反应时的能量变化 |
9.常温下,下列溶液中的微粒浓度关系正确的是( )
| A. | 氯气通入氢氧化钠溶液中:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 某溶液中只存在SO42-、OH-、NH4+、H+四种离子,则可能存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
13.常温下,下列溶液肯定呈碱性的是( )
| A. | 溶液中含有OH- | B. | 与氯化铵溶液反应放出氨气 | ||
| C. | 与金属铝反应放出氢气 | D. | 滴入甲基橙试液后,溶液呈黄色 |
14.下列说法不正确的是( )
| A. | 煤、石油、天然气均为化石燃料,它们属于可再生资源 | |
| B. | 生物质能来源于植物及其加工产品所贮存的能量 | |
| C. | 氢气的燃烧产物是水,不会污染环境,是理想的清洁燃料 | |
| D. | 大自然利用太阳能最成功的是植物的光合作用 |