题目内容
14.氨对人类的生产生活具有重要影响.(1)氨的制备与利用.
①工业合成氨的化学方程式是N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
②氨催化氧化生成一氧化氮反应的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(2)氨的定量检测.
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注.利用氨气传感器检测水体中氨氮含量的示意图如下:

①利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:c(OH-)增大,使NH4++OH-?NH3•H2O?NH3+H2O平衡正向移动,利于生成氨气,被空气吹出.
②若利用氨气传感器将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4mol•L-1,则水样中氨氮(以氨气计)含量为3.4mg•L-1.
(3)氨的转化与去除.
微生物燃料电池(MFC)是一种现代化氨氮去除技术.下图为MFC碳氮联合同时去除的氮转化系统原理示意图.
①已知A、B两极生成CO2和N2的物质的量之比为5:2,写出A极的电极反应式:CH3COO--8e-+2H2O═2CO2+7H+.
②用化学用语简述NH4+去除的原理:NH4+在好氧微生物反应器中转化为NO3-:NH4++2O2═NO3-+2H++H2O,NO3-在MFC电池正极转化为N2:2NO3-+12H++10e-═N2+6H2O.
分析 (1)①工业合成氨是利用氮气和氢气催化剂作用下高温高压反应生成氨气;
②氨气的催化氧化生成一氧化氮和水;
(2)①氢氧根离子浓度增大会结合铵根离子利于生成氨气;
②若利用氨气传感器将1L水样中的氨氮完全转化为N2时,依据氮元素守恒和电子转移守恒计算水样中氨氮(以氨气计)含量;
(3)①图示分析可知微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,NO3-离子在正极得到电子生成氮气发生还原反应,CH3COO-在原电池负极失电子生成二氧化碳气体,发生氧化反应,环境为酸性介质;
②NH4+在好氧微生物反应器中转化为NO3-,硝酸根离子在原电池正极发生还原反应生成氮气.
解答 解:(1)①工业合成氨是利用氮气和氢气催化剂作用下高温高压反应生成氨气,反应的化学方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,
故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;
②氨气的催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)①利用平衡原理分析含氨氮水样中加入NaOH溶液的作用是c(OH-)增大,使NH4++OH-?NH3•H2O?NH3+H2O平衡正向移动,利于生成氨气,被空气吹出,
故答案为:c(OH-)增大,使NH4++OH-?NH3•H2O?NH3+H2O平衡正向移动,利于生成氨气,被空气吹出;
②将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4mol,依据氮元素守恒2NH3~N2~6e-,
2NH3~N2~6e-,
2 6
n 6×10-4mol/L
n=2×10-4mol/L
水样中氨氮(以氨气计)含量=2×10-4mol/L×17g/mol=3.4×10-3g/L=3.4mg/L,
故答案为:3.4;
(3)①图示分析可知微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,NO3-离子在正极得到电子生成氮气发生还原反应,CH3COO-在原电池负极失电子生成二氧化碳气体,发生氧化反应,环境为酸性介质,则A极的电极反应式为:CH3COO--8e-+2H2O═2CO2+7H+,B电极反应式为:2NO3-+12H++10e-═N2+6H2O,
故答案为:CH3COO--8e-+2H2O═2CO2+7H+;
②NH4+在好氧微生物反应器中转化为NO3-,NH4++2O2═NO3-+2H++H2O,硝酸根离子在原电池正极发生还原反应生成氮气,2NO3-+12H++10e-═N2+6H2O,
故答案为:NH4+在好氧微生物反应器中转化为NO3-:NH4++2O2═NO3-+2H++H2O,NO3-在MFC电池正极转化为N2:2NO3-+12H++10e-═N2+6H2O.
点评 本题考查了物质组成和性质的实验探究、化学平衡影响因素分析、原电池原理和电极反应书写等知识,掌握基础读懂题干信息是解题关键,题目难度中等.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案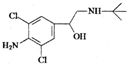
| A. | 该物质的分子式为C12H18ON2Cl2 | |
| B. | 该物质易溶于盐酸 | |
| C. | 该物质的1H核磁共振谱图中有8个吸收峰 | |
| D. | 该物质能发生的类型有:加成反应、酯化反应、消去反应、氧化反应等 |
| 选项 | 实验操作及现象 | 实验结论或实验目的 |
| A | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 溶液中有Na+,无K+ |
| B | 向硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 非金属性:Cl>Si |
| C | 向Ba(NO3)2溶液中通入SO2,有白色沉淀产生 | SO2具有还原性 |
| D | 将含少量KNO3杂质的NaCl晶体制成热的饱和溶液,冷却结晶,过滤 | 除去NaCl中的KNO3杂质 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 硝酸型酸雨的形成:3NO2+H2O═2HNO3+NO | |
| B. | 用Fe2(SO4)3做净水剂:Fe3++3H2O?Fe(OH)3+3H+ | |
| C. | 水垢中的CaSO4用Na2CO3溶液处理:Ca2++CO32-═CaCO3↓ | |
| D. | 向5 mL 0.1mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
| A. | 离子半径:r(Z2+)>r(Y2-) | |
| B. | Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物强 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | X、Y、Z、W元素的最高正价均等于其所在族的族序数 |
| A. | 光伏发电是将化学能转化为电能 | |
| B. | 钢铁吸氧腐蚀正极的电极反应式是O2+4e-+2H2O=4OH- | |
| C. | 通过电解NaCl水溶液的方法生产金属钠 | |
| D. | 铅蓄电池的负极材料是Pb,正极材料是PbSO4 |
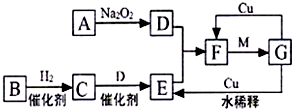 下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体.
下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体. .
.
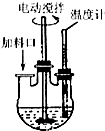 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.