题目内容
12.下列能用勒夏特列原理解释的是( )| A. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| B. | H2、I2、HI平衡时的混合气体加压后颜色变深 | |
| C. | SO2催化氧化生成SO3的反应,往往需要使用催化剂 | |
| D. | 红棕色的NO2加压后颜色先变深后变浅 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应且存在平衡过程,否则勒夏特列原理不适用.
解答 解:A.催化剂能同等改变正逆反应速率,但不影响平衡移动,不能用平衡移动原理解释,故A不选;
B.H2、I2、HI平衡时的混合气体加压后颜色变深,是因为加压后容器体积减小,碘浓度增大,但加压后平衡不移动,不能用平衡移动原理解释,故B不选;
C.催化剂能同等程度的改变正逆反应速率但不影响平衡移动,该反应中加催化剂的目的是加快反应速率缩短反应时间,不能用平衡移动原理解释,故C不选;
D.红棕色的NO2加压后,容器体积减小,碘浓度增大,所以颜色加深,但增大压强时,平衡向气体体积减小的方向即生成四氧化二氮的方向移动,所以颜色又变浅,即加压后颜色先变深后变浅,可以用平衡移动原理解释,故D选;
故选D.
点评 本题考查化学平衡移动原理,为高频考点,只有反应前后能引起平衡移动的才能用平衡移动原理解释,易错选项是B,

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.已知反应:2NO2(红棕色)?N204(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
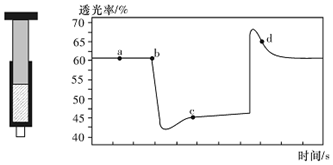

| A. | b点的操作是拉伸注射器 | |
| B. | d点:v(正)>v(逆) | |
| C. | c点与a点相比,c(N02)增大,c(N204)减小,若容器绝热则平衡常数Ka>Kc | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)<T(c) |
7.下列离子方程式中正确的是( )
| A. | 碳酸氢铵溶液加足量氢氧化钠并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| B. | Na218O2加入H2O中:2Na218O2+2H2O═4Na++4OH-+18O2↑ | |
| C. | 硫酸镁溶液加氨水:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | 氧化亚铁溶于稀硝酸:FeO+2H+═Fe2++H2O |
17.下列说法或表示正确的是( )
| A. | 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由“c(石墨)=c(金刚石)△H=+1.9KJ/mol”可知,金刚石没有石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H1,CH3COOH(aq)+OH-(aq)═H2O(l)+CH3COO-(aq)△H2,则△H1>△H2 | |
| D. | 在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=285.8KJ/mol |
4.已知金属钠和水反应的化学方程式为:2Na+2H2O═2NaOH+H2↑.将9.2g金属钠投入到足量的重水D2O中,则产生的气体中含有( )
| A. | 0.2 mol中子 | B. | 0.4 mol电子 | C. | 0.2 mol质子 | D. | 0.4 mol分子 |
1. 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | a>b | ||
| C. | 上述反应是吸热反应 | D. | 无法确定a、b的大小 |
2.NA为阿伏加德罗常数,下列分子数最少的是( )
| A. | 标准状况下2.24L氨气 | B. | 0.8mol氧气 | ||
| C. | 3.6g水 | D. | 含NA个氢分子的氢气 |