题目内容
8.在盛有鸡蛋清溶液的试管里,缓慢地加入饱和的硫酸铵溶液,观察到的现象是产生白色沉淀.这种现象叫盐析.再向试管里加入足里的蒸馏水,观察到的现象是沉淀溶解,这说明该过程是一个可逆过程,利用这个性质,可以分离、提纯蛋白质.该过程中蛋白质没有(有、没有)失去生理活性?分析 蛋白质具有盐析、变性等性质,其中在钠盐、铵盐、钾盐等溶液中发生盐析,为可逆过程,蛋白质没有失去生理活性,蛋白质在重金属盐溶液中可发生变性,失去生理活性,以此解答该题.
解答 解:向鸡蛋清中加入饱和硫酸铵溶液,可以观察到的现象为析出沉淀,说明饱和硫酸铵溶液可使蛋白质的溶解性变小,此过程叫做蛋白质的“盐析”为物理变化;再向试管里加入足量的蒸馏水,观察到的现象是变澄清,盐析是可逆过程,可以采用多次盐析的方法分离、提纯蛋白质,该过程中蛋白质没有失去生理活性,
故答案为:产生白色沉淀;盐析;沉淀溶解;可逆;没有.
点评 本题考查有机物的结构和性质,侧重考查蛋白质盐析的性质,为高频考点,题目难度不大,平时学习中注意蛋白质盐析和变性的在发生条件上、可逆性等方面的对比.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
18.用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 标准状况下,6.72LO2和N2的混合气体含有的原子数为0.6NA | |
| B. | 通常状况下,8g O2和O3 的混合气体含有的分子数是0.5NA | |
| C. | 常温常压下,2mol/L的100mL MgCl2溶液中,含有Cl- 个数为0.4NA | |
| D. | 标准状况下,11.2L H2在氧气中完全燃烧后得到的产物的分子数为0.5NA |
19.下列有关氧化还原反应的叙述正确的是( )
| A. | 肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 在反应中所有元素的化合价都发生变化 | |
| C. | 任何一个置换反应一定属于氧化还原反应 | |
| D. | 没有单质参与的化合反应和没有单质生成的分解反应不可能是氧化还原反应 |
16.下列属于酸性氧化物的是( )
| A. | 一氧化碳 | B. | 过氧化钠 | C. | 氧化铝 | D. | 二氧化硫 |
3.“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种.某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质:①是溶液 ②是胶体 ③具有丁达尔现象 ④不能透过半透膜 ⑤不能透过滤纸.其中正确的是( )
| A. | ①④⑥ | B. | ②③⑤ | C. | ②③④ | D. | ①③④⑥ |
13.NaCl是一种化工原料,可以制备一系列物质,如图所示.下列说法正确的是( )
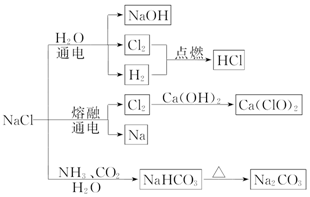

| A. | 25℃时,NaHCO3在水中的溶解度比 Na2CO3的大 | |
| B. | 石灰乳与 Cl2 的反应中,Cl2 既是氧化剂,又是还原剂 | |
| C. | 常温下干燥的 Cl2 能用钢瓶贮运,所以 Cl2 不与铁反应 | |
| D. | 图示转化反应都是氧化还原反应 |
20.为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填入对应的空格中.
实验方法:
A.加入足量铁粉,过滤
B.碘水
C.无水硫酸铜粉末
D.滴入酚酞试液.
| 实验目的 | 实验方法 |
| 证明地瓜粉中有淀粉 | B |
| 检验酒精中是否含有水 | C |
| 证明NaOH溶液呈碱性 | D |
| 除去FeCl2溶液中少量的FeCl3 | A |
A.加入足量铁粉,过滤
B.碘水
C.无水硫酸铜粉末
D.滴入酚酞试液.
11.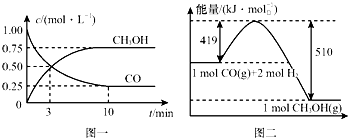 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
Ⅰ.已知反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃时的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(4)已知氢气的燃烧热为286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式:CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol.
(5)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
则下列关系正确的是ADE.
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量.
 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.Ⅰ.已知反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃时的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(4)已知氢气的燃烧热为286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式:CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol.
(5)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 | 反应物 投入的量 | 反应物的 转化率 | CH3OH 的浓度 | 能量变化(Q1、 Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1 kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2 kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3 kJ热量 |
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量.
12.下列能用勒夏特列原理解释的是( )
| A. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| B. | H2、I2、HI平衡时的混合气体加压后颜色变深 | |
| C. | SO2催化氧化生成SO3的反应,往往需要使用催化剂 | |
| D. | 红棕色的NO2加压后颜色先变深后变浅 |