题目内容
1. 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | a>b | ||
| C. | 上述反应是吸热反应 | D. | 无法确定a、b的大小 |
分析 由图象可知升高温度,G的体积分数减小,说明平衡正向移动,压强p1>p2,增大压强,G的体积分数增大,说明平衡逆向移动,以此解答该题.
解答 解:由图象可知升高温度,G的体积分数减小,说明平衡正向移动,则正反应为吸热反应,压强p1>p2,增大压强,G的体积分数增大,说明平衡逆向移动,因L为固体,则有a<b,只有C正确.
故选C.
点评 本题考查化学反应速率的影响,为高频考点,侧重于学生的分析能力的考查,本题注意把握图象曲线的变化特点以及外界条件下对平衡移动的影响,难度不大.

练习册系列答案
相关题目
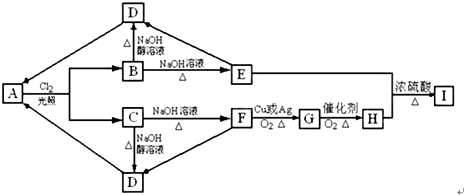
11. 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
Ⅰ.已知反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃时的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
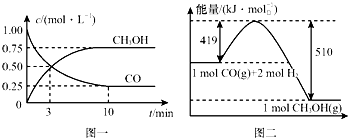
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(4)已知氢气的燃烧热为286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式:CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol.
(5)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
则下列关系正确的是ADE.
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量.
 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.Ⅰ.已知反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃时的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(4)已知氢气的燃烧热为286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式:CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol.
(5)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 | 反应物 投入的量 | 反应物的 转化率 | CH3OH 的浓度 | 能量变化(Q1、 Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1 kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2 kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3 kJ热量 |
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量.
12.下列能用勒夏特列原理解释的是( )
| A. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| B. | H2、I2、HI平衡时的混合气体加压后颜色变深 | |
| C. | SO2催化氧化生成SO3的反应,往往需要使用催化剂 | |
| D. | 红棕色的NO2加压后颜色先变深后变浅 |
9.以下关于混合物分离提纯操作或原理说法正确的是( )
| A. | 实验室中用含有Ca2+、Mg2+、Cl-的自来水制取蒸馏水,可采用蒸馏的方法 | |
| B. | 用CCl4萃取碘水的实验中,振荡静置后,上层为紫红色溶液 | |
| C. | 利用植物油的密度比水小的原理,可用分液的方法分离这两种液体混合物 | |
| D. | 蒸馏时,温度计的水银球应充分接触溶液 |
16.下列有关反应热的说法正确的是( )
| A. | 吸热反应一定需要加热,放热反应一定不需要加热 | |
| B. | 甲烷的燃烧热△H=-890kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ/mol | |
| C. | 常温常压下:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol则有:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ/mol | |
| D. | S (s)+O2(g)=SO2(g)△H1=-Q1 kJ/mol S (g)+O2(g)=SO2(g)△H2=-Q2 kJ/mol,则Q1<Q2 |
10.反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2.
下列说法正确的是( )
①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2.
下列说法正确的是( )
| A. | 两个反应中NaHSO4均为氧化产物 | |
| B. | 碘元素在反应①中被还原,在反应②中被氧化 | |
| C. | 氧化性:MnO2>SO${\;}_{4}^{2-}$>IO${\;}_{3}^{-}$>I2 | |
| D. | 反应①、②中生成等量的I2时转移电子数比为1:5 |
11.下列有关中和滴定的部分操作顺序正确的是( )
①标准溶液润洗滴定管 ②往滴定管中注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤滴定管 ⑥调整滴定管中液面在“0”或“0”以下刻度 ⑦记数.
①标准溶液润洗滴定管 ②往滴定管中注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤滴定管 ⑥调整滴定管中液面在“0”或“0”以下刻度 ⑦记数.
| A. | ⑤①②③④⑥⑦ | B. | ③⑤①②⑥⑦④ | C. | ③⑤②⑦①⑥④ | D. | ②⑥⑦①③⑤④ |