题目内容
7.下列离子方程式中正确的是( )| A. | 碳酸氢铵溶液加足量氢氧化钠并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| B. | Na218O2加入H2O中:2Na218O2+2H2O═4Na++4OH-+18O2↑ | |
| C. | 硫酸镁溶液加氨水:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | 氧化亚铁溶于稀硝酸:FeO+2H+═Fe2++H2O |
分析 A.漏写碳酸氢根离子和氢氧根离子的反应;
B.过氧化钠中的O元素还有一半存在于氢氧根离子中;
C.氢氧化镁不溶于氨水;
D.二者还发生氧化还原反应生成铁离子和NO.
解答 解:A.漏写碳酸氢根离子和氢氧根离子的反应,离子方程式为HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+NH3↑+CO32-,故A错误;
B.过氧化钠中的O元素还有一半存在于氢氧根离子中,离子方程式为2Na218O2+2H2O═4Na++2OH-+218OH-+18O2↑,故B错误;
C.硫酸镁不溶于氨水,离子方程式为:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+,故C正确;
D.二者还发生氧化还原反应生成铁离子和NO,离子方程式为3FeO+NO3-+10H+═3Fe3++NO↑+5H2O,故D错误;
故选C.
点评 本题考查离子方程式书写正误判断,为高频考点,明确离子方程式书写规则及反应实质是解本题关键,注意要遵循客观事实、原子守恒、电荷守恒及转移电子守恒,易错选项是D,注意D中亚铁离子能被酸性氧化.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种.某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质:①是溶液 ②是胶体 ③具有丁达尔现象 ④不能透过半透膜 ⑤不能透过滤纸.其中正确的是( )
| A. | ①④⑥ | B. | ②③⑤ | C. | ②③④ | D. | ①③④⑥ |
15.工业制硝酸时,NH3在500℃时可发生如下3 个反应:
下列说法正确的是( )
| 反应 | △H(kJ•mol-1) | 平衡常数K |
| ①4NH3(g)+5O2(g)?4NO(g)+6H2O(g) | -907 | 1.1×1026 |
| ②4NH3(g)+4O2(g)?2N2O(g)+6H2O(g) | -1105 | 4.4×1028 |
| ③4NH3(g)+3O2(g)?2N2 (g)+6H2O(g) | -1269 | 7.1×1034 |
| A. | N2(g)+O2(g)=2NO(g)△H=362 kJ•mol-1 | |
| B. | 增大压强,则反应②的K 不变,反应①和③的K 减小 | |
| C. | 500℃,2N2O(g)+O2(g)═4 NO(g) K=400 | |
| D. | 使用合适的催化剂可提高反应的选择性,提高NO 的产出率 |
2.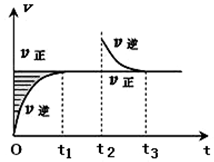 某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
 某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )| A. | Z和W在该条件下至少有一个是为气态 | |
| B. | t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 | |
| C. | 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 | |
| D. | 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等 |
12.下列能用勒夏特列原理解释的是( )
| A. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| B. | H2、I2、HI平衡时的混合气体加压后颜色变深 | |
| C. | SO2催化氧化生成SO3的反应,往往需要使用催化剂 | |
| D. | 红棕色的NO2加压后颜色先变深后变浅 |
19.黑火药发生爆炸的反应中:S+2KNO3+3C=K2S+N2↑+3CO2↑化合价降低的元素是( )
| A. | 只有N | B. | 只有S | C. | 只有C | D. | N和S |
16.下列有关反应热的说法正确的是( )
| A. | 吸热反应一定需要加热,放热反应一定不需要加热 | |
| B. | 甲烷的燃烧热△H=-890kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ/mol | |
| C. | 常温常压下:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol则有:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ/mol | |
| D. | S (s)+O2(g)=SO2(g)△H1=-Q1 kJ/mol S (g)+O2(g)=SO2(g)△H2=-Q2 kJ/mol,则Q1<Q2 |
 的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.该烷烃的一氯代物最多有4种.
的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.该烷烃的一氯代物最多有4种. .
.