题目内容
工业上正在研究利用C02来生产甲醇燃料,该方法的化学方程式为C02(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,一定温度下,在三个容积均为3.OL的恒容密闭容器中发生该反应:下列有关说法不正确的是( )
| 容器 | 起始物质的量/mol | 平衡物质的量/mol | |||
| 编 号 | 温度/℃ | C02 (g) | H2(g) | CH3OH(g) | H2 O(g) |
| I | T1 | 3 | 4 | O.5 | O.5 |
| Ⅱ | T1 | 1.5 | 2 | ||
| Ⅲ | T2 | 3 | 4 | O.8 | O.8 |
| A、若经过2min容器I中反应达平衡,则2min内平均速率(H2)=O.25 mol/(L?min) |
| B、达到平衡时,容器I中C02转化率的比容器Ⅱ的大 |
| C、达到平衡时,容器Ⅲ中反应放出的热量比容器Ⅱ的2倍少 |
| D、若容器I、Ⅱ、Ⅲ中对应条件下的平衡常数分别为K1、K2、K3,则K1=K2<K3 |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:
分析:A、根据化学化学反应速率的定义来回答;
B、根据化学反应的移动来回答;
C、根据平衡平衡原理知识来回答;
D、根据平衡移动来判平衡常数的大小.
B、根据化学反应的移动来回答;
C、根据平衡平衡原理知识来回答;
D、根据平衡移动来判平衡常数的大小.
解答:
解:A、2min容器I中反应达平衡,则2min内平均速率(H2)=
=O.25 mol/(L?min),故A正确;
B、容器Ⅰ充入的物质物质的量多,压强大,增大压强,平衡向气体体积减小的方向移动,达到平衡时,容器I中C02转化率的比容器Ⅱ的大,故B正确;
C、容器Ⅲ、Ⅰ为等效平衡,容器Ⅲ的转化率比容器Ⅰ大,放出的热量比容器Ⅰ多,比容器Ⅱ的2倍多,故C错误;
D、容器I、Ⅱ的温度相同,K1=K2,容器Ⅲ、Ⅰ为等效平衡,容器Ⅲ的转化率大,K1<K3,故D正确.
故选C.
| 0.5mol×3 |
| 3L×2min |
B、容器Ⅰ充入的物质物质的量多,压强大,增大压强,平衡向气体体积减小的方向移动,达到平衡时,容器I中C02转化率的比容器Ⅱ的大,故B正确;
C、容器Ⅲ、Ⅰ为等效平衡,容器Ⅲ的转化率比容器Ⅰ大,放出的热量比容器Ⅰ多,比容器Ⅱ的2倍多,故C错误;
D、容器I、Ⅱ的温度相同,K1=K2,容器Ⅲ、Ⅰ为等效平衡,容器Ⅲ的转化率大,K1<K3,故D正确.
故选C.
点评:本题考查较为综合,涉及反应速率、热化学方程式的含义以及化学平衡移动原理知识,难度中等.

练习册系列答案
相关题目
下列图示关系中不正确的是( )
A、 |
B、 |
C、 |
D、 |
下列有关化学反应与能量变化的说法中不正确的是( )
| A、物质发生化学反应的同时都伴随着能量变化 |
| B、伴随能量变化的过程都是化学变化 |
| C、在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 |
| D、并不是所有的化学变化都伴随着能量的放出 |
下列物质中,属于共价化合物的是( )
| A、NH4Cl |
| B、HN03 |
| C、NaCl |
| D、I2 |
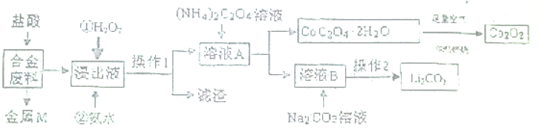
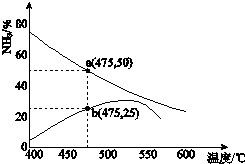 自然界中氮元素有多种存在形式.
自然界中氮元素有多种存在形式.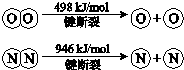
 常温下,碳酸的电离常数ka1=4.3×10-7,Ka2=5.6×10-12,如图所示的装置中,若活塞下移,下列说法正确的是( )
常温下,碳酸的电离常数ka1=4.3×10-7,Ka2=5.6×10-12,如图所示的装置中,若活塞下移,下列说法正确的是( )




