题目内容
下列图示关系中不正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:吸热反应和放热反应,反应热和焓变,燃烧热,中和热,原料与能源的合理利用
专题:
分析:A、根据燃烧热和中和热的概念来分析;
B、能源分为一次能源、二次能源;
C、氧化还原反应是有电子得失的反应;
D、生物质能是指利用大气、水、土地等通过光合作用而产生的各种有机体能源,即一切有生命的可以生长的有机能源物质通称为生物质生物质能.
B、能源分为一次能源、二次能源;
C、氧化还原反应是有电子得失的反应;
D、生物质能是指利用大气、水、土地等通过光合作用而产生的各种有机体能源,即一切有生命的可以生长的有机能源物质通称为生物质生物质能.
解答:
解:A、物质的燃烧和中和反应均为化学反应,故燃烧热和中和热均为反应热,故A正确;
B、能源分为一次能源、二次能源,一种能源不可能同时是一次能源和二次能源,故B错误;
C、氧化还原反应是有电子得失的反应,可能是吸热反应,也可能是放热反应,故C正确;
D、生物质能是指利用大气、水、土地等通过光合作用而产生的各种有机体能源,即一切有生命的可以生长的有机能源物质通称为生物质生物质能,故生物质能是可再生的新能源,故D正确.
故选B.
B、能源分为一次能源、二次能源,一种能源不可能同时是一次能源和二次能源,故B错误;
C、氧化还原反应是有电子得失的反应,可能是吸热反应,也可能是放热反应,故C正确;
D、生物质能是指利用大气、水、土地等通过光合作用而产生的各种有机体能源,即一切有生命的可以生长的有机能源物质通称为生物质生物质能,故生物质能是可再生的新能源,故D正确.
故选B.
点评:本题考查了物质的分类和归属问题,应注意的是氧化还原反应是有电子得失的反应,可能是吸热反应,也可能是放热反应.

练习册系列答案
相关题目
下列有关叙述正确的是( )
| A、液体氯化氢、液氮、液氯都是电解质 |
| B、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| C、NaCl为离子化合物,HCl为共价化合物,它们的判断方法是看熔融状态是否导电 |
| D、BaSO4的水溶液不易导电,故BaSO4是弱电解质 |
下列微粒可以在水中大量共存的是( )
| A、C6H12O6(葡萄糖)、Ag(NH3)2+、NO3-、OH- |
| B、AgI、Cl-、SO42-、NH4+ |
| C、Fe3+、K+、ClO-、NO3- |
| D、H2O2、Cl-、SO42-、Fe3+ |
下列对图象描述正确的是( )
A、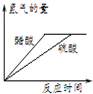 图表示体积和pH值均相同的稀硫酸和醋酸,与足量的镁反应生成H2量的关系 |
B、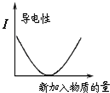 图表示向NaOH溶液中滴加稀盐酸,溶液导电性变化的关系 |
C、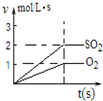 图表示2SO2(g)+O2(g)?2SO3(g)反应过程中,SO2和O2反应速率大小关系 |
D、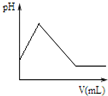 图表示向氨水中滴加稀硫酸时,溶液的pH大小变化关系 |
在世界海运史上曾发生过这样一个悲剧:一艘名叫“阿那吉纳号”的货轮满载着精铜砂,在向日本海岸行驶时突然发生大面积漏水,最终沉没.坚硬的钢制船体为什么会突然漏水呢?事后的事故调查结果表明导致沉船的原因与船上的精铜砂密切相关.下列对此调查结论的理解正确的是( )
| A、精铜砂装载过多导致沉船 |
| B、运输途中铜与空气中的氧气发生氧化反应导致质量增大超过船的承载能力 |
| C、在潮湿的环境中,船体与铜构成了原电池,加速了作为负极的船体的腐蚀 |
| D、在潮湿的环境中,船体与铜构成了电解池,钢制船体作阳极而被氧化腐蚀 |
下列说法中正确的是( )
| A、在氧化还原反应中,一定是一种元素被氧化,另一种元素被还原 |
| B、在氧化还原反应中,不一定所有元素的化合价都发生改变 |
| C、有单质参加反应或有单质生成的反应一定是氧化还原反应 |
| D、某元素由化合态转化为游离态,这种元素一定被还原了 |
 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如右图所示,下列说正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如右图所示,下列说正确的是( )| A、N4分子属于一种新型的化合物 |
| B、N4分子中只含有非极性键 |
| C、1 mol N4分子所含共价键数为4NA |
| D、N4沸点比P4(白磷)高 |
为了保护环境,工业上常用氨气除去废气中氮氧化物(NOx):NOx+NH3=N2+H2O(l).已知某厂每升废气中含NOx 0.0672L(只含NO和NO2),向100.000L废气中通入10.000L氨气可使NOx完全转化,测得反应后气体体积变为103.952L(气体体积均折算到标准状况).有关说法中正确的是( )
| A、每生成1.5mol N2被氧化的气体有3mol |
| B、处理过程中转移的电子数目约为1.339Na |
| C、NOx中x的数值为1.2 |
| D、出去废气中的NOx至少需要氨0.24mol |
工业上正在研究利用C02来生产甲醇燃料,该方法的化学方程式为C02(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,一定温度下,在三个容积均为3.OL的恒容密闭容器中发生该反应:下列有关说法不正确的是( )
| 容器 | 起始物质的量/mol | 平衡物质的量/mol | |||
| 编 号 | 温度/℃ | C02 (g) | H2(g) | CH3OH(g) | H2 O(g) |
| I | T1 | 3 | 4 | O.5 | O.5 |
| Ⅱ | T1 | 1.5 | 2 | ||
| Ⅲ | T2 | 3 | 4 | O.8 | O.8 |
| A、若经过2min容器I中反应达平衡,则2min内平均速率(H2)=O.25 mol/(L?min) |
| B、达到平衡时,容器I中C02转化率的比容器Ⅱ的大 |
| C、达到平衡时,容器Ⅲ中反应放出的热量比容器Ⅱ的2倍少 |
| D、若容器I、Ⅱ、Ⅲ中对应条件下的平衡常数分别为K1、K2、K3,则K1=K2<K3 |