题目内容
下列物质中,属于共价化合物的是( )
| A、NH4Cl |
| B、HN03 |
| C、NaCl |
| D、I2 |
考点:共价键的形成及共价键的主要类型
专题:
分析:一般来说,非金属元素之间形成离子键,活泼金属元素与非金属元素形成离子键,含离子键的化合物一定为离子化合物,共价化合物中只含共价键,以此来解答.
解答:
解:A.NH4Cl含铵根离子与氯离子形成的离子键,为离子化合物,故A不选;
B.只含共价键,且属于化合物,属于共价化合物,故B选;
C.只含钠离子与氯离子之间的离子键,为离子化合物,故C不选;
D.只含I-I共价键,但属于单质,故D不选;
故选B.
B.只含共价键,且属于化合物,属于共价化合物,故B选;
C.只含钠离子与氯离子之间的离子键,为离子化合物,故C不选;
D.只含I-I共价键,但属于单质,故D不选;
故选B.
点评:本题考查化学键及物质的分类,为高频考点,把握化学键形成的一般规律及化学键与物质类别的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
在世界海运史上曾发生过这样一个悲剧:一艘名叫“阿那吉纳号”的货轮满载着精铜砂,在向日本海岸行驶时突然发生大面积漏水,最终沉没.坚硬的钢制船体为什么会突然漏水呢?事后的事故调查结果表明导致沉船的原因与船上的精铜砂密切相关.下列对此调查结论的理解正确的是( )
| A、精铜砂装载过多导致沉船 |
| B、运输途中铜与空气中的氧气发生氧化反应导致质量增大超过船的承载能力 |
| C、在潮湿的环境中,船体与铜构成了原电池,加速了作为负极的船体的腐蚀 |
| D、在潮湿的环境中,船体与铜构成了电解池,钢制船体作阳极而被氧化腐蚀 |
为了能够让制得的Fe(OH)2不被空气氧化 某同学采用如图所示装置进行实验,下列分析错误的是 ( )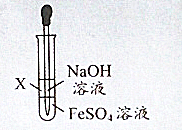

| A、该实验中NaOH溶液往往事先煮沸下,目的是为了赶走其中溶有的O2 |
| B、试剂X可以是食用油、苯或乙醇 |
| C、该实验能较长时间观察到白色沉淀的现象 |
| D、该反应的离子方程式为:Fe2++2OH-=Fe(OH)2↓ |
下列化学反应在理论上不能用于设计成原电池的是( )
| A、4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H<0 |
| B、CH3CH2OH(l)+3O2(g)→2CO2(g)+3H2O(l)△H<0 |
| C、Al(OH)3(s)+NaOH(aq)═NaAlO2(aq)+2H2O(l)△H<0 |
| D、H2(g)+Cl2(g)═2HCl(g)△H<0 |
工业上正在研究利用C02来生产甲醇燃料,该方法的化学方程式为C02(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,一定温度下,在三个容积均为3.OL的恒容密闭容器中发生该反应:下列有关说法不正确的是( )
| 容器 | 起始物质的量/mol | 平衡物质的量/mol | |||
| 编 号 | 温度/℃ | C02 (g) | H2(g) | CH3OH(g) | H2 O(g) |
| I | T1 | 3 | 4 | O.5 | O.5 |
| Ⅱ | T1 | 1.5 | 2 | ||
| Ⅲ | T2 | 3 | 4 | O.8 | O.8 |
| A、若经过2min容器I中反应达平衡,则2min内平均速率(H2)=O.25 mol/(L?min) |
| B、达到平衡时,容器I中C02转化率的比容器Ⅱ的大 |
| C、达到平衡时,容器Ⅲ中反应放出的热量比容器Ⅱ的2倍少 |
| D、若容器I、Ⅱ、Ⅲ中对应条件下的平衡常数分别为K1、K2、K3,则K1=K2<K3 |
按气流方向,能通过如图装置收集的气体是( )

| A、N2 |
| B、NO |
| C、NO2 |
| D、H2 |
对下列化学用语的理解和描述均正确的是( )
A、电子式 可以表示羟基.也可以表示氢氧根离子 可以表示羟基.也可以表示氢氧根离子 |
B、填充模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C、原子结构示意图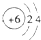 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
D、结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-10,下列说法正确的是( )
| A、该溶液的pH一定是9 |
| B、该溶液的pH一定是5 |
| C、该溶液的pH可能是9 |
| D、不会有这样的溶液 |