题目内容
 常温下,碳酸的电离常数ka1=4.3×10-7,Ka2=5.6×10-12,如图所示的装置中,若活塞下移,下列说法正确的是( )
常温下,碳酸的电离常数ka1=4.3×10-7,Ka2=5.6×10-12,如图所示的装置中,若活塞下移,下列说法正确的是( )A、 |
B、 |
C、 |
D、 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:碳酸是弱酸,碳酸溶液中存在二氧化碳的溶解平衡和电离平衡,CO2+H2O?H2CO3,H2CO3?H++HCO3-,HCO3-?H++CO32-,压力增大,导致活塞下移,二氧化碳在水中的溶解度增大,c(H2CO3)增大,碳酸的电离平衡正向移动,溶液酸性增强,pH降低,阴阳离子数目都增大,据此分析.
解答:
解:A、碳酸溶液中存在二氧化碳的溶解平衡,压力增大,导致活塞下移,二氧化碳在水中的溶解度增大,所以随压力增大二氧化碳分子在水中溶解数目增多,故A正确;
B、碳酸溶液中存在电离平衡,压力增大,导致活塞下移,碳酸的电离平衡正向移动,溶液酸性增强,pH降低,故B错误;
C、溶液中不存在水解平衡,故C错误;
D、碳酸溶液中存在电离平衡,压力增大,导致活塞下移,碳酸的电离平衡正向移动,溶液中阴阳离子数目都增大,故D正确;
故选AD.
B、碳酸溶液中存在电离平衡,压力增大,导致活塞下移,碳酸的电离平衡正向移动,溶液酸性增强,pH降低,故B错误;
C、溶液中不存在水解平衡,故C错误;
D、碳酸溶液中存在电离平衡,压力增大,导致活塞下移,碳酸的电离平衡正向移动,溶液中阴阳离子数目都增大,故D正确;
故选AD.
点评:本题考查了气体的溶解平衡以及弱电解质的电离平衡,注意图象分析,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
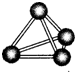 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如右图所示,下列说正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如右图所示,下列说正确的是( )| A、N4分子属于一种新型的化合物 |
| B、N4分子中只含有非极性键 |
| C、1 mol N4分子所含共价键数为4NA |
| D、N4沸点比P4(白磷)高 |
为了能够让制得的Fe(OH)2不被空气氧化 某同学采用如图所示装置进行实验,下列分析错误的是 ( )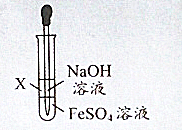

| A、该实验中NaOH溶液往往事先煮沸下,目的是为了赶走其中溶有的O2 |
| B、试剂X可以是食用油、苯或乙醇 |
| C、该实验能较长时间观察到白色沉淀的现象 |
| D、该反应的离子方程式为:Fe2++2OH-=Fe(OH)2↓ |
工业上正在研究利用C02来生产甲醇燃料,该方法的化学方程式为C02(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,一定温度下,在三个容积均为3.OL的恒容密闭容器中发生该反应:下列有关说法不正确的是( )
| 容器 | 起始物质的量/mol | 平衡物质的量/mol | |||
| 编 号 | 温度/℃ | C02 (g) | H2(g) | CH3OH(g) | H2 O(g) |
| I | T1 | 3 | 4 | O.5 | O.5 |
| Ⅱ | T1 | 1.5 | 2 | ||
| Ⅲ | T2 | 3 | 4 | O.8 | O.8 |
| A、若经过2min容器I中反应达平衡,则2min内平均速率(H2)=O.25 mol/(L?min) |
| B、达到平衡时,容器I中C02转化率的比容器Ⅱ的大 |
| C、达到平衡时,容器Ⅲ中反应放出的热量比容器Ⅱ的2倍少 |
| D、若容器I、Ⅱ、Ⅲ中对应条件下的平衡常数分别为K1、K2、K3,则K1=K2<K3 |
按气流方向,能通过如图装置收集的气体是( )

| A、N2 |
| B、NO |
| C、NO2 |
| D、H2 |
2012年10月24日飓风“桑迪”袭击美国.一阵飓风过后,海面的巨浪上竟燃烧着熊熊大火.海水会燃烧的原因是( )
| A、飓风与海水发生剧烈摩擦,产生的巨大热能使水分子分解,引起氢气燃烧 |
| B、飓风使海水温度升高,产生高温水蒸气,达到水的着火点,使海水燃烧 |
| C、飓风产生高温,使氮气在空气中剧烈燃烧 |
| D、以上说法均有可能 |
对下列化学用语的理解和描述均正确的是( )
A、电子式 可以表示羟基.也可以表示氢氧根离子 可以表示羟基.也可以表示氢氧根离子 |
B、填充模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C、原子结构示意图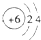 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
D、结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
下列说法正确的是( )
| A、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
| B、重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 |
| C、在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
| D、Cl-、S2-、Ca2+、K+半径逐渐减小 |