题目内容
10.下列各选项中,正确的是( )| A. | 实验室要配制0.lmol/LNaOH溶液400mL,需称取NaOH 固体1.6g | |
| B. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| C. | Al2O3熔点很高,可用作耐火材料 | |
| D. | 纯锌和铁相连接后,插入同一稀盐酸中,锌极上发生氧化还原反应 |
分析 A.配制0.lmol/LNaOH溶液400mL,选择500mL容量瓶,结合m=cVM计算;
B.焰色反应为元素的性质;
C.熔点高的物质可作难火材料;
D.原电池中,Zn为负极.
解答 解:A.配制0.lmol/LNaOH溶液400mL,选择500mL容量瓶,NaOH的质量为m=cVM=0.5L×0.1mol/L×40g/mol=2.0g,故A错误;
B.焰色反应为元素的性质,则焰火的五彩缤纷是某些金属元素性质的展现,为物理变化,故B错误;
C.熔点高的物质可作难火材料,则Al2O3熔点很高,可用作耐火材料,故C正确;
D.原电池中,Zn为负极,失去电子发射氧化反应,故D正确;
故选CD.
点评 本题考查化学实验方案的评价,为高频考点,把握溶液配制、焰色反应、原电池为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
20.对于平衡体系:mA(g)+nB(g)?pC(g)+qD(g),下列判断正确的是( )
| A. | 若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.55 倍,则m+n<p+q | |
| B. | 若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△H<0 | |
| C. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| D. | 若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小 |
5.下列实验操作正确的是( )
| A. | 过滤操作中,漏斗下端要紧靠烧杯内壁,而分液操作中,无此要求 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶的溶液中 | |
| C. | 蒸发操作时,应用玻璃棒不断搅拌待有大量晶体出现,停止搅拌,继续把水份蒸干 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
15.某兴趣小组甲设计了以下装置和方法测定空气中SO2含量.你认为可行的操作是B
| 序号 | A | B | C |
| 装置 | 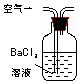 | 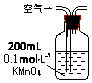 | 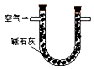 |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
2.根据如图提供的信息,下列所得结论不正确的是( )
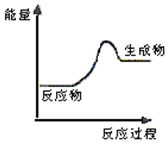

| A. | 该反应可能为吸热反应 | |
| B. | 该反应一定有能量转化成了生成物的化学能 | |
| C. | 反应物比生成物稳定 | |
| D. | 生成物的总能量高于反应物的总能量,反应不需要加热 |
3.滴定实验是化学学科中重要的定量实验.请回答下列问题:
(1)酸碱中和滴定--用标准盐酸滴定未知浓度的NaOH溶液.
①下列操作造成测定结果偏高的是AC
A.盛装未知液的锥形瓶先用蒸馏水洗过,再用未知液润洗
B.滴定终点读数时,俯视滴定管刻度,其他操作正确.
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,酸式滴定管尖嘴无气泡,滴定后有气泡
②该学生的实验操作如下:
A、用碱式滴定管取稀NaOH 25.00mL,注入锥形瓶中,加入酚酞做指示剂.
B、用待测定的溶液润洗碱式滴定管.
C、用蒸馏水洗干净滴定管.
D、取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下.
E、检查滴定管是否漏水.
F、另取锥形瓶,再重复操作一次.
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
滴定操作的正确顺序是(用序号填写)E→C→B→A→D→G→F
(2)氧化还原滴定--为了分析某残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行滴定,反应的离子方程式5Fe2++MnO${\;}_{4}^{-}$+8H+═5Fe3++Mn2++4H2O
①KMnO4标准溶液应盛装在酸式滴定管中(填“酸式”或“碱式”)
②某同学称取5.000g残留物,经预处理后在容量瓶中配制成100mL溶液,每次移取25.00mL试样溶液,用1.000×10-2 mol•L-1 KMnO4标准溶液滴定.四次实验消耗标准溶液的体积分别为19.90mL、20.00mL、20.10mL、20.60mL.计算该残留物中铁元素的质量分数是4.480%.
(3)沉淀滴定--滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是C.
A. NaCl B. NaBr C. Na2CrO4 D.NaCN.
(1)酸碱中和滴定--用标准盐酸滴定未知浓度的NaOH溶液.
①下列操作造成测定结果偏高的是AC
A.盛装未知液的锥形瓶先用蒸馏水洗过,再用未知液润洗
B.滴定终点读数时,俯视滴定管刻度,其他操作正确.
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,酸式滴定管尖嘴无气泡,滴定后有气泡
②该学生的实验操作如下:
A、用碱式滴定管取稀NaOH 25.00mL,注入锥形瓶中,加入酚酞做指示剂.
B、用待测定的溶液润洗碱式滴定管.
C、用蒸馏水洗干净滴定管.
D、取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下.
E、检查滴定管是否漏水.
F、另取锥形瓶,再重复操作一次.
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
滴定操作的正确顺序是(用序号填写)E→C→B→A→D→G→F
(2)氧化还原滴定--为了分析某残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行滴定,反应的离子方程式5Fe2++MnO${\;}_{4}^{-}$+8H+═5Fe3++Mn2++4H2O
①KMnO4标准溶液应盛装在酸式滴定管中(填“酸式”或“碱式”)
②某同学称取5.000g残留物,经预处理后在容量瓶中配制成100mL溶液,每次移取25.00mL试样溶液,用1.000×10-2 mol•L-1 KMnO4标准溶液滴定.四次实验消耗标准溶液的体积分别为19.90mL、20.00mL、20.10mL、20.60mL.计算该残留物中铁元素的质量分数是4.480%.
(3)沉淀滴定--滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是C.
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |