题目内容
5.下列实验操作正确的是( )| A. | 过滤操作中,漏斗下端要紧靠烧杯内壁,而分液操作中,无此要求 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶的溶液中 | |
| C. | 蒸发操作时,应用玻璃棒不断搅拌待有大量晶体出现,停止搅拌,继续把水份蒸干 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
分析 A.过滤、分液时漏斗下端均紧靠烧杯内壁,防止液滴飞溅;
B.蒸馏时,温度计测定馏分的温度;
C.蒸发时,出现大量固体时,停止加热,利用余热加热;
D.分液时,避免上下层液体混合.
解答 解:A.过滤时漏斗下端均紧靠烧杯内壁,防止液滴飞溅,且分液时分液漏斗下端均紧靠烧杯内壁,防止液滴飞溅,故A错误;
B.蒸馏时,温度计测定馏分的温度,则温度计的水银球在烧瓶的支管口处,故B错误;
C.蒸发时,出现大量固体时,停止加热,利用余热加热,则不能蒸干,故C错误;
D.分液时,避免上下层液体混合,则分液漏斗中下层液体从下口放出,上层液体从上口倒出,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯实验、实验基本操作和基本技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
15.将35.0g锌粉与少量浓硫酸在加热的条件充分反应,共收集到混合气体11.2L(标准状况),则过量的锌粉的质量为( )
| A. | 1.0g | B. | 2.0g | C. | 2.5g | D. | 3.5g |
16.下列事实可以证明MOH是弱碱的有( )
①0.1mol/L MOH溶液能使酚酞溶液变红
②常温下,0.1mol/L MOH溶液的pH=12
③0.1mol/L MOH溶液的导电性比0.1mol/L NaOH溶液弱
④等体积的0.1mol/L MOH溶液与0.1mol/L HCl溶液恰好完全反应.
①0.1mol/L MOH溶液能使酚酞溶液变红
②常温下,0.1mol/L MOH溶液的pH=12
③0.1mol/L MOH溶液的导电性比0.1mol/L NaOH溶液弱
④等体积的0.1mol/L MOH溶液与0.1mol/L HCl溶液恰好完全反应.
| A. | .①②③ | B. | .②③ | C. | ②④ | D. | ③④ |
13.下列事实可用勒沙特列原理解释的是( )
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | H2、I2、HI平衡混合气体加压后颜色变深 | |
| C. | 钢铁在潮湿的空气中容易生锈 | |
| D. | 加入催化剂有利于氨催化氧化的反应 |
20.通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一.下列反应的推断或解释正确的是( )
| 操作 | 可能的实验现象 | 解释 | |
| A | 某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 将SO2中通入硝酸钡溶液中 | 有白色沉淀生成 | BaSO3不溶于硝酸 |
| C | 同温同压下,用pH试纸测定相同浓度的碳酸钠和硫酸钠溶液的酸碱性 | 碳酸钠溶液显碱性,硫酸钠溶液显中性 | 碳酸钠发生了水解 |
| D | 向淀粉KI溶液中通入Cl2 | 溶液先变蓝后褪色 | Cl2先表现氧化性、后表现强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
10.下列各选项中,正确的是( )
| A. | 实验室要配制0.lmol/LNaOH溶液400mL,需称取NaOH 固体1.6g | |
| B. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| C. | Al2O3熔点很高,可用作耐火材料 | |
| D. | 纯锌和铁相连接后,插入同一稀盐酸中,锌极上发生氧化还原反应 |
14.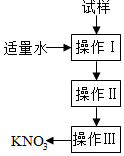 实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )
实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )
 实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )
实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )| A. | 操作Ⅰ是过滤,将固体分离除去 | |
| B. | 操作Ⅱ是加热浓缩,趁热过滤,除去杂质氯化钠 | |
| C. | 操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 | |
| D. | 操作Ⅰ~Ⅲ总共只需一次过滤操作 |
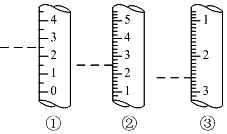 托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础.