题目内容
15.一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应:C(s)+CO2(g)?2CO(g),反应平衡时,体系中气体体积分数与温度的关系如图所示.下列说法正确的是( )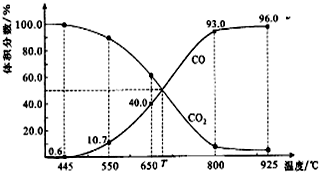
| A. | 550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 该反应为吸热反应 |
分析 A.可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,则v正,v退均减小,又该反应是气体体积增大的反应,则平衡正向移动;
B.由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,根据三段式进行计算;
C.由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态;
D.图象分析可知T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,升温一氧化碳浓度增大,二氧化碳浓度减小,平衡正向进行,正反应为吸热反应.
解答 解:A.可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,平衡向着正向移动,v正,v退均减小,故A错误;
B、由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,
则有C(s)+CO2(g)?2CO(g)
开始 1 0
转化 x 2x
平衡; 1-x 2x
所以$\frac{2x}{1-x+2x}$×100%=40%,解得x=0.25mol,则CO2的转化率为:$\frac{0.25}{1}$×100%=25%,故B正确;
C.由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%,所以T℃时,若充入等体积的CO2和CO即为平衡状态,则平衡不移动,故C错误;
D.图象分析可知T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,此点后,化学反应随升高温度一氧化碳浓度增大,二氧化碳浓度减小,平衡正向进行,升温平衡向吸热反应反应进行,所以正反应为吸热反应,故D正确;
故选BD.
点评 本题考查了化学平衡的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案①铁在潮湿空气中生锈是自发过程
②NH4HCO3受热分解是熵增的过程
③反应焓变是决定反应能否自发进行的唯一因素
④自发过程中,熵值都是增大的
⑤温度、压强一定时,放热且熵增加的反应一定能自发进行.
| A. | ①②③④⑤ | B. | ①②⑤ | C. | ③④ | D. | ④⑤ |
| A. | 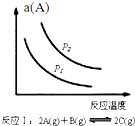 如图反应:△H<0,P2>P1 | |
| B. |  如图反应:△H<0,T1>T2 | |
| C. |  如图反应:△H>0,T2>T1 | |
| D. |  如图反应:△H>0,T2>T1或△H<0,T2<T1 |
| 类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
| A | CO | CuO | H2SO4 | NH3•H2O | Na2S |
| B | CO2 | Na2O | HCl | NaOH | NaCl |
| C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
| D | NO2 | CaO | HNO3 | Cu(OH)2CO3 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
 .
.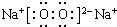 ,该产物所含有的化学键类型有离子键、非极性键.
,该产物所含有的化学键类型有离子键、非极性键.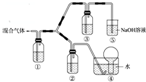 A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$倍;C与E同主族.
A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$倍;C与E同主族.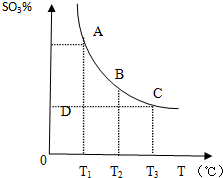 运用化学原理研究元素及其化合物的反应有重要意义.
运用化学原理研究元素及其化合物的反应有重要意义.