题目内容
2.在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)?MHx+2y(s)△H<0,达到化学平衡.下列有关叙述正确的是( )| A. | 容器内气体压强保持不变 | |
| B. | 吸收ymolH2只需1 mo1MHx | |
| C. | 若向容器内通入少量氢气,则V(放氢)>V(吸氢) | |
| D. | 若降温,该反应的平衡常数增大 |
分析 MHx(s)+yH2(g)?MHx+2y(s)△H<0,该反应是一个反应前后气体物质的量减小的放热反应,
A.平衡时气体的物质的量不变,容器内气体压强保持不变;
B.该反应为可逆反应,不能完全转化,反应物不能完全转化;
C.若向容器内通入少量氢气,相当于增大压强,平衡正向移动;
D.降低温度平衡正向移动.
解答 解:MHx(s)+yH2(g)?MHx+2y(s)△H<0,该反应是一个反应前后气体物质的量减小的放热反应,
A.该反应的正反应气体的物质的量减小,压强减小,当平衡时气体的物质的量不变,容器内气体压强保持不变,故A正确;
B.该反应为可逆反应,不能完全转化,吸收ymol H2需大于1mol MHx,故B错误;
C.若向容器内通入少量氢气,相当于增大压强,平衡正向移动,则v(放氢)<v(吸氢),故C错误;
D.该反应的正反应是放热反应,若降温,平衡正向移动,该反应的平衡常数增大,故D正确;
故选AD.
点评 本题考查化学平衡的影响因素及平衡移动,侧重考查学生分析判断能力,把握恒容及物质的量与压强的关系是解答的关键,注意:化学平衡常数只与温度有关,题目难度不大.

练习册系列答案
相关题目
13.对可逆应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 化学反应速率关系是:2υ正(NH3)=3υ正(H2O) | |
| B. | 达到化学平衡时,4υ正(O2)=5υ逆(NO) | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
12.在蒸发皿中将下列盐溶液蒸干并灼烧,能得到该物质的固体的是( )
| A. | 氯化铝 | B. | 碳酸氢钠 | C. | 硫酸镁 | D. | 亚硫酸钠 |

 A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$倍;C与E同主族.
A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$倍;C与E同主族. 工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则
工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则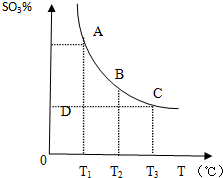 运用化学原理研究元素及其化合物的反应有重要意义.
运用化学原理研究元素及其化合物的反应有重要意义.