题目内容
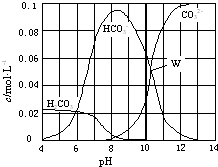 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )| A、W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
| B、pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol?L-1 |
| C、pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| D、pH=11的溶液中:c(Na+)+c (H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.W点所示的溶液中c(CO32-)=c(HCO3-),溶液显碱性;
B.根据物料守恒判断;
C.先判断溶液中的溶质,再根据电离程度与水解程度的相对大小分析;
D.根据电荷守恒分析.
B.根据物料守恒判断;
C.先判断溶液中的溶质,再根据电离程度与水解程度的相对大小分析;
D.根据电荷守恒分析.
解答:
解:A.W点所示的溶液中c(CO32-)=c(HCO3-),溶液显碱性,则c(OH-)>c(H+),所以溶液中离子浓度关系为:c(CO32-)=c(HCO3-)>c(OH-)>c(H+),故A正确;
B.pH=4,说明反应中有CO2生成,所以根据物料守恒可知c(H2CO3)+c(HCO3-)+c(CO32-)<0.1 mol?L-1,故B错误;
C.根据图象可知pH=8时,溶液中碳酸氢钠的浓度远远大于碳酸钠的浓度,这说明反应中恰好是生成碳酸氢钠,HCO3-的水解程度大于电离程度,则c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C正确;
D.根据图象可知pH=11时,溶液碳酸钠的浓度远远大于碳酸氢钠的浓度,溶液中电荷守恒为:c(Na+)+c (H+)=c(OH-)+c(Cl-)+2c(CO32-)+c(HCO3-),故D错误;
故选AC.
B.pH=4,说明反应中有CO2生成,所以根据物料守恒可知c(H2CO3)+c(HCO3-)+c(CO32-)<0.1 mol?L-1,故B错误;
C.根据图象可知pH=8时,溶液中碳酸氢钠的浓度远远大于碳酸钠的浓度,这说明反应中恰好是生成碳酸氢钠,HCO3-的水解程度大于电离程度,则c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C正确;
D.根据图象可知pH=11时,溶液碳酸钠的浓度远远大于碳酸氢钠的浓度,溶液中电荷守恒为:c(Na+)+c (H+)=c(OH-)+c(Cl-)+2c(CO32-)+c(HCO3-),故D错误;
故选AC.
点评:本题考查碳酸钠和盐酸反应中离子浓度大小比较,属于综合性试题的考查,对学生的思维能力提出了较高的要求,该题的关键是在明确反应原理的基础上利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,然后结合图象和题意灵活运用即可,难度中等.

练习册系列答案
相关题目
农药波尔多液不能用铁制容器盛放,是因为铁能与该农药中的硫酸铜起反应,在该反应中,铁( )
| A、是还原剂 | B、是氧化剂 |
| C、被还原 | D、被氧化 |
将2.3g金属钠投入到足量水中,得到a g溶液;2.5g金属镁投入到与水等质量的足量盐酸中,得到b g溶液,则a、b的关系为( )
| A、a>b | B、a<b |
| C、a=b | D、不能确定 |
下列各溶液中,Na+物质的量浓度最大的是( )
| A、1L 0.3mol/L Na2SO4溶液 |
| B、4L 0.5mol/L NaCl溶液 |
| C、5L 0.4mol/L NaOH |
| D、2L 0.15mol/L Na3PO4 |
下列离子方程式中,正确的是( )
| A、铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、氯气与氯化亚铁溶液反应:2FeCl2+Cl2═2FeCl3 |
| C、氯化铁溶液与铁反应:Fe3++Fe═2Fe2+ |
| D、氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-═Fe(OH)3↓ |
关于食品添加剂的作用,叙述正确的是( )
| A、食品中的苯甲酸钠是防腐剂 |
| B、火腿中的亚硝酸钠是发色剂 |
| C、饮料中的柠檬酸是发泡剂 |
| D、豆腐中的硫酸钙是防腐剂 |