题目内容
(1)在25℃、101kPa下,23g乙醇燃烧生成CO2和液态水时放热QkJ热量,写出乙醇燃烧热的热化学方程式: .
(2)已知:H2(g)+
O2(g)=H2O(g)△H=-241.8kJ?mol一1
CO(g)+
O2(g)=CO2(g)△H=-283.0kJ?mol一1
写出CO(g)+H2O(g)=H2 (g)+CO2(g) 的热化学方程式是: .
(2)已知:H2(g)+
| 1 |
| 2 |
CO(g)+
| 1 |
| 2 |
写出CO(g)+H2O(g)=H2 (g)+CO2(g) 的热化学方程式是:
考点:热化学方程式
专题:化学反应中的能量变化
分析:(1)23g乙醇燃烧生成CO2和液态水时放热QkJ热量,1mol乙醇即46g乙醇完全燃烧生成CO2和液态水时放热2QkJ热量,标注物质聚集状态和对应焓变书写;
(2)结合热化学方程式和盖斯定律计算得到所需热化学方程式.
(2)结合热化学方程式和盖斯定律计算得到所需热化学方程式.
解答:
解:(1)在25℃、101kPa下,23g乙醇燃烧生成CO2和液态水时放热QkJ热量,1mol乙醇即46g乙醇完全燃烧生成CO2和液态水时放热2QkJ热量,写出乙醇燃烧热的热化学方程式为:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l)△H=-2QkJ/mol;
故答案为:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l)△H=-2QkJ/mol;
(2)①H2(g)+
O2(g)=H2O(g)△H=-241.8kJ?mol一1
②CO(g)+
O2(g)=CO2(g)△H=-283.0kJ?mol一1
依据盖斯定律②-①得到热化学方程式为:CO(g)+H2O(g)=H2 (g)+CO2(g)△H=-41.2KJ/mmol;
故答案为:CO(g)+H2O(g)=H2 (g)+CO2(g)△H=-41.2KJ/mmol.
故答案为:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l)△H=-2QkJ/mol;
(2)①H2(g)+
| 1 |
| 2 |
②CO(g)+
| 1 |
| 2 |
依据盖斯定律②-①得到热化学方程式为:CO(g)+H2O(g)=H2 (g)+CO2(g)△H=-41.2KJ/mmol;
故答案为:CO(g)+H2O(g)=H2 (g)+CO2(g)△H=-41.2KJ/mmol.
点评:本题考查了热化学方程式和盖斯定律计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
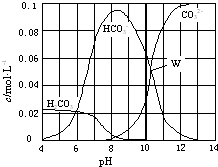 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )| A、W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
| B、pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol?L-1 |
| C、pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| D、pH=11的溶液中:c(Na+)+c (H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-) |
 已知可逆反应aA(g)+bB(g)?cC(g),体系中A、C的浓度随温度的变化曲线如下图1所示,下列说法不正确的是( )
已知可逆反应aA(g)+bB(g)?cC(g),体系中A、C的浓度随温度的变化曲线如下图1所示,下列说法不正确的是( )| A、该反应于T2温度时曾达到过化学平衡 |
| B、该反应正反应是放热反应 |
| C、T1、T3时正反应和逆反应速率相等 |
| D、该反应的速率随温度的变化情况可用上图2表示 |
 有可逆反应A(g)+B(s)=2C(g)在不同温度下经过一定时间,混合物中C的百分含量与温度关系如图所示,那么:
有可逆反应A(g)+B(s)=2C(g)在不同温度下经过一定时间,混合物中C的百分含量与温度关系如图所示,那么: (4)
(4) (5)CH3Cl
(5)CH3Cl  (7)CH3COOH (8)CH3CHO (9)CH3COOC2H5 (10)CH3OCH3
(7)CH3COOH (8)CH3CHO (9)CH3COOC2H5 (10)CH3OCH3