题目内容
下列各溶液中,Na+物质的量浓度最大的是( )
| A、1L 0.3mol/L Na2SO4溶液 |
| B、4L 0.5mol/L NaCl溶液 |
| C、5L 0.4mol/L NaOH |
| D、2L 0.15mol/L Na3PO4 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:电解质离子的浓度=电解质浓度×电解质电离出该离子的数目,与溶液的体积无关,据此结合选项判断.
解答:
解:A、1L 0.3mol/L Na2SO4溶液Na+浓度为0.3mol/L×2=0.6mol/L;
B、4L 0.5mol/L NaCl溶液中Na+浓度为0.5mol/L×1=0.5mol/L;
C、5L 0.4mol/L NaOH溶液中Na+浓度为0.4mol/L×1=0.4mol/L;
D、2L0.15mol/L Na3PO4溶液中Na+浓度为0.15mol/L×3=0.45mol/L;
故选A.
B、4L 0.5mol/L NaCl溶液中Na+浓度为0.5mol/L×1=0.5mol/L;
C、5L 0.4mol/L NaOH溶液中Na+浓度为0.4mol/L×1=0.4mol/L;
D、2L0.15mol/L Na3PO4溶液中Na+浓度为0.15mol/L×3=0.45mol/L;
故选A.
点评:本题考查物质的量浓度,注意电解质溶液中离子的浓度与电解质浓度的计算.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
甲烷分子中C-H键的键角为( )
| A、120° |
| B、112°30′ |
| C、109°28′ |
| D、60° |
铝合金在日常生活、建筑装潢、航空航天和汽车制造等方面均有着广泛的用途.下列关于铝合金具有广泛用途的分析不正确的是( )
| A、铝元素在地壳中的含量高,储量丰富 |
| B、铝容易形成致密的氧化膜,抗腐蚀性能好 |
| C、铝的冶炼技术基本成熟,可以大量生产铝 |
| D、化学性质稳定,常温下不与任何酸碱反应 |
下列叙述不正确的是( )
| A、CH4与C4H10互为同系物 |
| B、C5H12有三种同分异构体 |
| C、甲烷与氯气在光照条件下能发生取代反应 |
| D、所有烷烃中均有碳碳单键 |
向一个密闭的容器中充入SO2与18O2,加入适当的催化剂并加热到一定的温度使之发生反应,反应一段时间后,18O会存在于( )
| A、SO2中 |
| B、SO2和SO3中 |
| C、SO2和O2中 |
| D、SO2、SO3和O2中 |
下列数字表示元素的原子序数,其中包含金属、非金属、稀有气体元素各一种的是( )
| A、3、16、20 |
| B、2、4、18 |
| C、11、15、18 |
| D、9、10、17 |
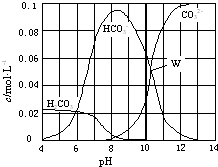 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )| A、W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
| B、pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol?L-1 |
| C、pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| D、pH=11的溶液中:c(Na+)+c (H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-) |
 某同学为测定维生素C中碳、氢的质量分数,取维生素C样品研碎,称取该试样3.52克置于铂舟并放入燃烧管中,不断通入氧气流.用酒精喷灯持续加热样品,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重1.44克和5.28克,生成物完全被吸收.试回答以下问题:
某同学为测定维生素C中碳、氢的质量分数,取维生素C样品研碎,称取该试样3.52克置于铂舟并放入燃烧管中,不断通入氧气流.用酒精喷灯持续加热样品,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重1.44克和5.28克,生成物完全被吸收.试回答以下问题: 有可逆反应A(g)+B(s)=2C(g)在不同温度下经过一定时间,混合物中C的百分含量与温度关系如图所示,那么:
有可逆反应A(g)+B(s)=2C(g)在不同温度下经过一定时间,混合物中C的百分含量与温度关系如图所示,那么: