题目内容
将2.3g金属钠投入到足量水中,得到a g溶液;2.5g金属镁投入到与水等质量的足量盐酸中,得到b g溶液,则a、b的关系为( )
| A、a>b | B、a<b |
| C、a=b | D、不能确定 |
考点:钠的化学性质,镁的化学性质
专题:计算题,元素及其化合物
分析:根据 2Na+2H2O=2NaOH+H2↑、Mg+2HCl=MgCl2+H2↑,利用差量法来计算.
解答:
解:设金属钠与水反应生成氢气的质量为x,镁与盐酸反应生成氢气的质量为y,则
2Na+2H2O=2NaOH+H2↑
46 2
2.3g x
解得x=0.1g,溶液增重为2.3g-0.1g=2.2g=a,
Mg+2HCl=MgCl2+H2↑
24 2
2.5g y
解得y=
g,溶液增重为2.5g-
g≈2.292=b,
则a<b,
故选B.
2Na+2H2O=2NaOH+H2↑
46 2
2.3g x
解得x=0.1g,溶液增重为2.3g-0.1g=2.2g=a,
Mg+2HCl=MgCl2+H2↑
24 2
2.5g y
解得y=
| 5 |
| 24 |
| 5 |
| 24 |
则a<b,
故选B.
点评:本题考查学生利用化学反应方程式的计算,明确发生的化学反应是解答本题的关键,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
下列物质中,不能使品红溶液褪色的是( )
| A、Cl2 |
| B、SO3 |
| C、SO2 |
| D、活性炭 |
下列说法不正确的是( )
| A、铁锈的形成一定发生了氧化还原反应 |
| B、复分解反应都不是氧化还原反应 |
| C、燃烧都是放热反应,也都是氧化还原反应 |
| D、分解反应都是氧化还原反应 |
铝合金在日常生活、建筑装潢、航空航天和汽车制造等方面均有着广泛的用途.下列关于铝合金具有广泛用途的分析不正确的是( )
| A、铝元素在地壳中的含量高,储量丰富 |
| B、铝容易形成致密的氧化膜,抗腐蚀性能好 |
| C、铝的冶炼技术基本成熟,可以大量生产铝 |
| D、化学性质稳定,常温下不与任何酸碱反应 |
下列变化属于物理变化的是( )
| A、水沸腾产生大量水蒸气 |
| B、木材燃烧 |
| C、钢铁生锈 |
| D、黑火药爆炸 |
下列叙述不正确的是( )
| A、CH4与C4H10互为同系物 |
| B、C5H12有三种同分异构体 |
| C、甲烷与氯气在光照条件下能发生取代反应 |
| D、所有烷烃中均有碳碳单键 |
向一个密闭的容器中充入SO2与18O2,加入适当的催化剂并加热到一定的温度使之发生反应,反应一段时间后,18O会存在于( )
| A、SO2中 |
| B、SO2和SO3中 |
| C、SO2和O2中 |
| D、SO2、SO3和O2中 |
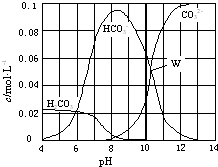 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )| A、W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
| B、pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol?L-1 |
| C、pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| D、pH=11的溶液中:c(Na+)+c (H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-) |